1、填空题 (1)X原子在第二电子层上只有一个空轨道,则X是______;其轨道表示式为______;R原子的3p轨道上只有一个未成对电子,则R原子可能是______、______;Y原子的核电荷数为29,其电子排布式是______,其在元素周期表中的位置是______,是属于______区的元素.
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:______、______、______.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
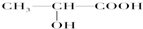
______
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)______.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______H2SO3;?H3PO4______H3PO3.
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为______杂化,分子的立体构型为______.
BF3分子中,中心原子的杂化方式为______杂化,分子的立体构型为______.
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______.
2、选择题 下列说法中正确的是( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
3、填空题 某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是
________________。
4、选择题 下列说法正确的是( )
A.元素周期律是元素原子核外电子排布周期性变化的结果
B.HCl、H2S、PH3、SiH4的热稳定性和还原性均依次增强
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.非金属元素的原子两两结合形成的化合物不一定是共价化合物
5、简答题 U、V、W、X、Y、Z六种原子序数依次增大前20号元素,其中U和X,W和Y分别在同一主族,Y的原子序数是W的原子序数两倍,Z的原子序数是U和X的原子序数之和.根据以上条件回答下列问题:
(1)写出U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子形成的化合物的电子式:______;
(2)W元素可分别U、Y形成多种常见的阴离子.某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸溶液,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少.
由此得出的结论是______.