1、选择题 关于小苏打水溶液的表述正确的是
A.c(Na+)+ c(H+)=c(HCO3—)+ c(CO32—)+ c(OH—)
B.c (Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3)
C.HCO3—的电离程度大于HCO3—的水解程度
D.存在的电离有:NaHCO3=Na++HCO3—;HCO3— H++CO32—
H++CO32—
参考答案:B
本题解析:A、不符合电荷守恒,应该是c(Na+)+ c(H+)=c(HCO3—)+ 2c(CO32—)+ c(OH—),A不正确;B、符合物料守恒,正确;C、碳酸氢钠溶液中HCO3—的电离程度小于HCO3—的水解程度,溶液显碱性,C不正确;D、溶液中还存在水的电离平衡,D不正确,答案选B。
本题难度:一般
2、选择题 下列物质的溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分不相同的是(?)
A.FeCl 2、FeCl 3
B.NaHCO3、Na2CO3
C.NaAlO2、AlCl3
D.Mg(HCO3)2、MgCl2
参考答案:C
本题解析:略
本题难度:一般
3、选择题 常温下有A、B、C、D分别是CH3COONa、NH4Cl、Na2SO4和盐酸四种溶液中的一种,已知A、B溶液的pH相同,A、C溶液中水的电离程度相同,下列说法正确的是
A. B溶液的pH<7 ,D溶液的pH>7
B. B溶液中水的电离程度最大
C. C与D等体积混合后,溶液中c(OH-)=c(CH3COOH)+ c(H+)
D. A与B等体积混合后,溶液中c(NH4+)> c(Cl-)> c(H+) > c(OH-)
参考答案:C
本题解析:A、A、B溶液的pH相同,上述4种溶液pH可能相同的只能是NH4Cl和盐酸,所以A、B是NH4Cl和盐酸中的一种;硫酸钠溶液呈中性,对水的电离无影响;醋酸钠溶液呈碱性,促进水的电离;又A、C溶液中水的电离程度相同,所以A是NH4Cl溶液,B是盐酸;C是CH3COONa,D是Na2SO4溶液。D溶液的pH=7,错误;B、B为盐酸,抑制水的电离,所以B溶液中水的电离程度最小,错误;C、C与D等体积混合后,Na2SO4不水解,CH3COONa水解,根据质子守恒规律,水电离产生的氢离子与氢氧根离子浓度相等,部分氢离子醋酸根离子结合成为CH3COOH,所以c(OH-)=c(CH3COOH)+ c(H+),正确;D、NH4Cl与盐酸等体积混合,溶液中的氯离子浓度一定大于铵根离子浓度,c(Cl-)> c(NH4+),错误,答案选C。
本题难度:一般
4、选择题 下列是有关0.1 mol/L醋酸钡[(CH3COO)2Ba]溶液微粒浓度的比较,其中错误的是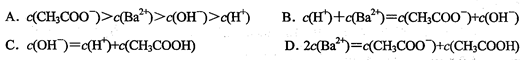
参考答案:
B
本题解析:
本题考查电解质溶液中离子浓度大小的比较,关键要应用好溶液中的三大守恒——物料守恒、电荷守恒、质子守恒。CH3COO一在水中发生水解生成CH3COOH, c (CH3COO)减小,但分比c(Ba2+)大,水解后溶液呈碱性,C(OH一) >C(H+),故A正确,由溶液中的电荷守恒,2c(Ba2+) + C(H+)=c(CH3COO一)+ C(OH一),B错;由水的电离的质子守恒,有C(OH一) = C(H+)+CH3COOH,C正确;由醋酸钡的物料守恒,有2c(Ba2+)= c(CH3COO一)+CH3COOH,D正确;
本题难度:一般
5、选择题 在10mL 0.1mol·L—1NaOH溶液中加入同体积同浓度的CH3COOH溶液,反应后溶液中各粒子浓度关系错误的是:
A.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
B.c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
C.c(Na+)=c(CH3COO—)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO—)+c(OH—)
参考答案:A
本题解析:混合后为醋酸钠的溶液;该溶液水解呈碱性故有c(Na+)>c(CH3COO—)>c(OH—)>c(H+),A错误,B正确;C、为物料守恒;D、为电荷守恒。
本题难度:简单