| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《中和滴定实验》高频试题预测(2019年最新版)(一)
(1)经计算,市售白醋总酸量=______g/100mL. (2)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号). a.碱式滴定管在滴定时未用标准NaOH溶液润洗 b.碱式滴定管的尖嘴在滴定前无气泡,滴定后有气泡 c.锥形瓶中加入待测白醋溶液后,再加少量水 d.锥形瓶在滴定时剧烈摇动,有少量液体溅出 (二)用双指示剂法测定纯碱的含量 如图的滴定曲线表示:用0.1000mol/L?HCl滴定?20.00ml?0.1000mol/L?Na2CO3 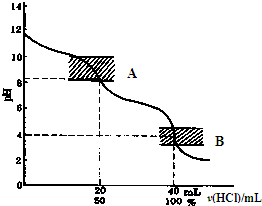 ①A处选用______作指示剂比较合适; ②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验误差,应剧烈摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:______. (II)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?探究过程如下. (1)[猜想]:Al2O3能作过氧化氢分解的催化剂. (2)[实验验证]: 实验步骤 实验现象 实验结论 实验一 将带火星的木条伸入装有过氧化氢溶液的试管中 木条不复燃 常温下过氧化氢溶液不分解(或分解很少)______ 实验二 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 木条复燃 ______ |
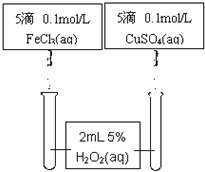
2、实验题 某学生欲用已知物质的量浓度的HCl测定未知浓度的NaOH溶液,将HCl置于滴定管,氢氧化钠溶液置于锥形瓶,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定未知浓度的NaOH溶液,滴定到终点时锥形瓶中颜色变化为______________。
(2)下列操作中可能无法会怎样影响所测NaOH溶液浓度(填偏大、偏小或不影响)
A.酸式滴定管未用标准浓度的HCl润洗就直接注入标准盐酸___________
B.读数时,开始平视,结束时俯视液面___________
(3)某学生根据3次实验记录有关数据如下
请选择合理的数据计算NaOH溶液的物质的量浓度:c(NaOH)=________________。
3、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级二水合氯化钙(CaCl2· 2H2O的质量分数97.0%~103.0%)的主要流程如下: 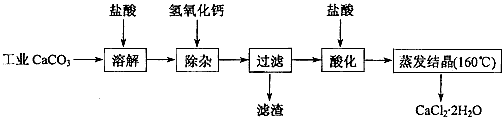
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以出去溶液中的少量Al3+、Fe3+检验Fe(OH)3是否沉淀完全的试验操作是__________________________ 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________________ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为_____________________。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______________________________。
4、选择题 25℃时,在20 mL的盐酸中,逐滴加入0.2 mol/L的氨水,溶液的pH与氨水体积的关系如下图所示。则下列说法正确的是 
[? ]
A.滴加前盐酸的物质的量浓度为0.1 mol/L
B.B点的横坐标a=10
C.A、B间的任一点,溶液中都有c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.如果将氨水换为同浓度的NaOH溶液,则滴加20 mL时溶液的pH一定小于C点的pH
5、选择题 中和滴定实验中,下列说法正确的是
[?]
A.滴定时视线必须注视滴定管中液面刻度的变化
B.锥形瓶必须用待测液润洗
C.滴定前必须使滴定管尖嘴部分充满液体
D.滴定管不能用标准液润洗
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《配制一定物.. | |