1、简答题 在实验室里模拟工业用钛铁矿(FeTiO3)提取钛主要过程如下:
步骤1:在加热条件下,用硫酸溶解10.0g钛铁矿,将TiO32-转化为TiO2+,还生成FeSO4;
步骤2:利用降温结晶法,使得绿矾析出,滤出绿矾后,加热滤液水解得到钛酸(H2TiO3)沉淀,将钛酸进行焙烧制得TiO2.
步骤3:TiO2+C+Cl2
TiCl4+CO(未配平)
步骤4:TiCl4(g)+Mg(g)→Ti(s)+MgCl2(l)(未配平)
请结合上述信息完成下列问题:
(1)写出步骤1的化学反应方程式:______;该反应______(填“是”或“不是”)氧化还原反应.
(2)配平步骤3的化学反应方程式,并标出电子转移的方向和数目.TiO2+C+Cl2TiCl4+CO______
(3)步骤3的反应中还原产物是______.
(4)上述过程中参加反应的金属镁为1.2g,假设实验过程中无损失,则该钛铁矿中FeTiO3的质量分数为______.
参考答案:(1)反应物有FeTiO3、H2SO4,生成物有:TiOSO4和FeSO4,化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,元素的化合价都未发生变化,
故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;不是;
(2)TiO2+C+Cl2△
本题解析:
本题难度:一般
2、选择题 有6.85g铅的氧化物,用足量的CO 在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00g固体沉淀物,这种铅的氧化物的化学式为
A.PbO
B.PbO2
C.Pb3O4
D. Pb3O4和PbO2的混合物
参考答案:C
本题解析:4.00g固体沉淀物为碳酸钙沉淀,则n(CaCO3)=4.00g÷100g/mol=0.04mol,铅氧化物中的氧原子被CO夺取生成CO2,根据碳元素、氧元素守恒可知CO~O~CO2~CaCO3,所以铅氧化物中的氧原子的物质的量为0.04mol,氧元素的质量为0.04mol×16g/mol=0.64g,则铅氧化物中的铅元素的质量为6.85g-0.64g=6.21g,其物质的量为
6.21g ÷ 207g/mol=0.03mol,所以铅氧化物中铅原子与氧原子的物质的量之比为=0.03mol:0.04mol=3:4,因此铅氧化物的化学式为Pb3O4,故C项正确。
本题难度:一般
3、填空题 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,震荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是l,不用填写): ___口+___口+___口→__HIO3+__口
(2)整个过程中的还原剂是______。
(3)把KI换成KBr,则CCl4层变为____色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_________。
?(4)加碘盐中含碘量为20 mg-50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2_____L(标准状况,保留2位小数)。
参考答案:(1)I2+5Cl2+6H2O→2HIO3+10HCl
(2)KI、I2
(3)红棕;HBrO3>Cl2>HIO3
(4)10.58
本题解析:
本题难度:一般
4、选择题 在5NH4NO3====2HNO3+4N2↑+9H2O的反应中,还原产物和氧化产物的质量之比是(?)
A.5:3
B.3:5
C.5:4
D.1:1
参考答案:B
本题解析:略
本题难度:一般
5、填空题 实验室制取氯气时,若没有MnO2则用KMnO4代替,据此回答下列问题:
(1)配平该反应
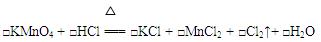
(2)被氧化的HCl与未被氧化的HCl的物质的量之比为?
参考答案:(1)、2;16;2;2;5;6 (2分)
(2) ?5:3?(3分)
本题解析:略
本题难度:简单