1、选择题 常温下,下列不发生反应的一组物质是
① 硅与NaOH溶液 ②硅与盐酸 ③ 硅与氢氟酸 ④ 二氧化硅与碳酸钠 ⑤ 二氧化硅NaOH溶液 ⑥ 二氧化硅与浓硝酸
A.①②④
B.③④⑥
C.②⑤⑥
D.②④⑥
参考答案:D
本题解析:硅的化学性质稳定,常温下除了与氟气、氢氟酸、和强碱外,它不易与其他物质如氢气、氧气、氯气等反应。
本题难度:简单
2、选择题 已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是?
A.Fe3+
B.Br2
C.Cr2O72—
D.HNO3
参考答案:C
本题解析:由题目所给物质变化可知,Fe3+、Br2、Cr2O72—、HNO3可得到的电子数分别为1、2、6、3个,故氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是Cr2O72—
本题难度:简单
3、选择题 将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL
B.当金属全部溶解时收集到NO气体的体积一定为2.24 L
C.参加反应的金属的总质量3.6 g<m<9.6 g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
参考答案:B
本题解析:由题意可知,生成沉淀的质量比原合金的质量增加5.1g,即为增加的氢氧根离子的质量,所以氢氧根离子的物质的量为0.3mol,也是反应中转移电子的物质的量。A、沉淀中氢氧根离子的物质的量为0.3mol,则需要氢氧化钠的体积是100mL,所以当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL,正确;B、反应中转移电子的物质的量是0.3mol,即NO得物质的量是0.1mol,但未指明标准状况,所以气体的体积不一定是2.24L,错误;C、若金属全部是镁,则其质量为0.3mol/2×24g/mol=3.6g,若金属全部是铜,则其质量为0.3mol/2×64g/mol=9.6g,所以固体的质量介于3.6g~9.6g之间,正确;D、金属全部溶解时被还原的硝酸也即生成的NO的物质的量是0.1mol,未被还原的硝酸即与氢氧化钠反应生成硝酸钠的物质的量是0.3mol,所以共消耗硝酸0.4mol,正确,答案选B。
本题难度:一般
4、填空题 实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg=Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_______________价。
(2)以上反应中的氧化剂为_____________________,当有1 mol CuI参与反应时,转移电子_______________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式: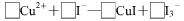
参考答案:
(1)+1
(2)CuI?0.5
(3)2 ?5 ?2 ?1
本题解析:标注元素的化合价:CuI中Cu为+1,I为-1;Cu2HgI4中I为-1价,Cu 若为+2价,则Hg为0价,Cu若为+1价,Hg为+2价,很明显,Cu取+1价比较合理。
根据化合价变化情况,可以判断出CuI发生了歧化,既是氧化剂,又是还原剂。
本题难度:简单
5、选择题 氨氧化制硝酸的反应如下(未配平):①NH3 + O2 →NO + H2O?②NO + O2 → NO2
③NO2+H2O→HNO3+NO,如将氨全部氧化得2mol硝酸,理论上需氧气的物质的量是( ?)
A.2mol
B.3 mol
C.4 mol
D.5 mol
参考答案:C
本题解析:根据氮原子守恒可知,生成2mol硝酸,需要2mol氨气,氮元素的化合价从-3价升高到+5价,失去8个电子,则反应中转移电子的物质的量是16mol。氧气在反应中得到4个电子,因此根据电子得失守恒可知,需要氧气的物质的量是16mol÷4=4mol,答案选C。
点评:该题是中等难度计算题,也是高考中的常见考点,明确反应的原理并能依据电子得失守恒是答题的关键,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般