1、选择题 离子键的强弱主要决定于离子半径和离子电荷值。一般规律是:离子半径越小,电荷值越大,则离子键越强。试分析:①K2O ?②CaO ?③MgO 的离子键由强到弱的顺序是?
A.③②①
B.③①②
C.②①③
D.①②③
参考答案:A
本题解析:离子半径是镁离子小于钙离子小于钾离子,因此离子键最强的是氧化镁,其次是氧化钙,所以正确的答案是A。
本题难度:简单
2、填空题 已知下列热化学方程式:
①CaCO3(s) CaO(s)+CO2(g) ΔH=+177.7 kJ
CaO(s)+CO2(g) ΔH=+177.7 kJ
②C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
③HCl(l)+NaOH(l) NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
NaCl(l)+H2O(l) ΔH=-57.3 kJ·mol-1
④C(s)+O2(g) CO2(g) ΔH=-393.5 kJ·mol-1
CO2(g) ΔH=-393.5 kJ·mol-1
⑤CO(g)+O2(g) CO2(g) ΔH="-283" kJ·mol-1
CO2(g) ΔH="-283" kJ·mol-1
⑥2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有 。
(2)上述反应中,表示燃烧热的热化学方程式有 。
参考答案: (1)①③ (2)④⑤
本题解析:①中ΔH单位应为 kJ· mol-1,③式中各物质聚集状态标注中,除H2O外,其余应为(aq)。
考点:燃烧热 能源
本题难度:一般
3、简答题 有下列六种固体物质:①氯化镁、②金刚石、③白磷、④过氧化钠、⑤干冰、⑥二氧化硅,请回答有关这六种固体物质的问题.
(1)将这六种固体按不同晶体类型分成三组,并填写下表:
(2)其中以共价键相结合,原子彼此间形成空间网状结构的化合物是______(填编号).晶体内存在分子的单质是______(填编号).含有共价键的离子化合物是______;
(3)其中硬度最大的物质是______(填编号);熔点最低的物质是______(填编号).
(4)请写出氯化镁的电子式______,干冰的结构式______.
参考答案:(1)①氯化镁由阴阳离子构成,是离子晶体;
②金刚石由原子构成,是原子晶体;
③白磷由分子构成,是分子晶体;
④过氧化钠由阴阳离子构成,是离子晶体;
⑤干冰由分子构成,是分子晶体;
⑥二氧化硅由原子构成,是原子晶体;
故答案为:①④、②⑥、③⑤;?
(2)以共价键相结合,原子彼此间形成空间网状结构的是金刚石和二氧化硅,金刚石是单质,二氧化硅是化合物;
分子晶体内存在分子,白磷是单质,干冰是化合物;
过氧化钠晶体中过氧根离子和钠离子之间的化学键是离子键,氧原子和氧原子之间的化学键是非极性共价键,所以过氧化钠中存在离子键和共价键.
故答案为:⑥;③;④.
(3)原子晶体硬度大,金刚石的硬度最大;分子晶体的熔点较低,但标况下白磷是固体,二氧化碳是气体,所以干冰的熔点低.
故答案为②;⑤.?
(4)氯化镁阴阳离子间的作用力是离子键,所以氯化镁的电子式为
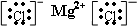
;干冰中原子间的作用力是极性共价键,所以干冰的结构式为O=C=O,
故答案为:
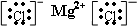
;O=C=O,
本题解析:
本题难度:一般
4、选择题 已知:C(s)+H2O(g) CO(g)+H2(g) ΔH =" +130" kJ·mol-1
CO(g)+H2(g) ΔH =" +130" kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH="a" kJ·mol-1
2CO(g) ΔH="a" kJ·mol-1
H—H、O O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
A.-332
B.-118
C.-220
D.+350
 NH4++OH-;若向氨水中加入少量NH4Cl晶体,平衡逆向移动,NH3·H2O的电离程度减小,由于c(OH-)减小,所以溶液的pH也减小,正确。
NH4++OH-;若向氨水中加入少量NH4Cl晶体,平衡逆向移动,NH3·H2O的电离程度减小,由于c(OH-)减小,所以溶液的pH也减小,正确。