1、填空题 23.已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为?,其在充电时阳极反应为?;
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为?;
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是?;
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4?mol。
2、选择题 (08广州综合测试,17)甲醇(CH3OH)燃料电池可用于笔记本电脑、汽车等,一极通入甲醇,另一极通入氧气,电池工作时,H+由负极移向正极。下列叙述正确的是(?)
A.氧气为负极
B.甲醇为负极
C.正极反应为:O2+4H++4e-="=" 2H2O
D.负极反应为:CH3OH+H2O+6e- ="=" CO2↑+ 6H+
3、填空题 (15分)I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)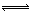 2ClNO(g) ?H1<0 其平衡常数为K1
2ClNO(g) ?H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s)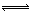 NaNO3(s)+ClNO(g) ?H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) ?H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)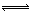 2NaNO3(s)+2NO(g)+Cl2(g) ?H3的平衡常数K= (用K1、K2表示)。?H3= (用?H1、?H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ?H3的平衡常数K= (用K1、K2表示)。?H3= (用?H1、?H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II.第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:
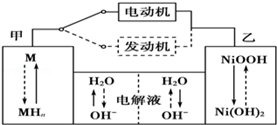
其总反应式为H2+2NiOOH 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
4、填空题 (14分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
1.在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-akJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②下列措施中能使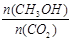 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=_________。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为______________________ _________。
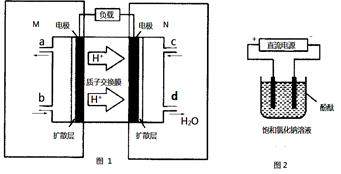
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:________________________ _________。
5、选择题 一种新型燃料电池,它是用两根惰性金属做电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,发生的电极反应为:X极:CH4+10OH--8e-=CO32-+7H2O?Y极:4H2O+2O2+8e-=8OH-关于此燃料电池的下列说法中正确的是( )
A.X极为正极,Y极为负极
B.工作一段时间后,KOH的物质的量不变
C.在标准状况下通入5.6LO2完全反应,则有1.0mol电子发生转移
D.该电池工作时甲烷一极附近溶液的pH升高