1、选择题 铅蓄电池在现代生活中有广泛的应用。其电极材料是Pb和PbO2,电解质是稀硫酸。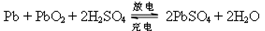 ,下列说法正确的是?
,下列说法正确的是?
A.铅蓄电池使用一段时间后要添加硫酸
B.电池充电时,阴极反应为:Pb-2e-+SO42-
C.电池充电时,电池正极应和电源的正极相连接
D.电池放电时,电池正极周围溶液pH不断增大
参考答案:CD
本题解析:铅蓄电池的工作原理:
放电时:(负极)Pb?电极式为Pb-2e-+ SO42-="=" PbSO4
?(正极):PbO2?电极式为PbO2+ 2e-+4 H++SO42-="=" PbSO4+ 2H2O;
故放电时总反应式为:? Pb+PbO2+2H2SO4="=" 2PbSO4+ 2H2O;
充电时:(阴极)?电极式为PbSO4+ 2 e-="=Pb" +SO42-
?(阳极)电极式为PbSO4+ 2e-+2H2O=PbO2+4H+;
故充电时总反应式为2PbSO4+2H2O==PbO2+Pb+2H2SO4
铅蓄电池充电时,负极要与电源的负极相连,正极与电源正极相连。
本题难度:一般
2、选择题 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
A.放电时,LiMn2O4发生氧化反应
B.放电时,负极反应式为Li++LiMn2O4+e-=Li2Mn2O4
C.该电池不能用水溶液作为电解质
D.放电过程中Li 向负极移动
向负极移动
参考答案:C
本题解析:锂离子电池放电时为原电池,根据电池反应Li+LiMn2O4=Li2Mn2O4得其负极电极反应式为:Li—e—= Li+;正极电极反应式为:LiMn2O4+e—+ Li+= Li2Mn2O4。
A错,放电时,LiMn2O4得到电子,发生还原反应;B错,放电时,正极反应式为Li++LiMn2O4+e-=Li2Mn2O4;C正确,Li的金属性很强,能与水发生反应;D错,放电过程中Li 向正极移动
向正极移动
本题难度:一般
3、选择题 Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2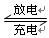 Li2S2O4。下列说法正确的是(?)
Li2S2O4。下列说法正确的是(?)
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e一=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
参考答案:C
本题解析:略
本题难度:一般
4、选择题 Li-SO2电池具有输出功率高和低温性能好等特点,其电解质是LiBr,溶剂是碳酸丙烯酯和乙睛,电池反应为2Li+2SO2
Li2S2O4.下列说法正确的是( )
A.该电池反应为可逆反应
B.放电时,Li+向正极移动
C.充电时,阴极反应式为Li++e-═Li
D.该电池的电解质溶液可以换成LiBr的水溶液
参考答案:A、电池反应为2Li+2SO2

Li2S2O4,不是可逆反应,指的是充放电时(条件不一样)反应方向相反,故A错误;
B、原电池工作时,阳离子向正极移动,故B正确;
C、充电时,电解原理,阴极上发生得电子的还原反应,电极反应式为Li++e-═Li,故C正确;
D、Li可以与水反应,故电解质应为非水材料,即电解质溶液不能换成LiBr的水溶液,故D错误.
故选BC.
本题解析:
本题难度:简单
5、简答题 工业上合成氨在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g)△H=-92.44kJ/mol.其部分工艺流程如图1所示:

(1)合成氨所需要的原料气中,氮气取自______,氢气来源于______.
(2)对原料气进行净化处理的目的是______.
(3)设备A的名称是______,设备B的名称是______.
(4)在20~50Mpa时,工业合成氨选择在400-500℃的温度进行反应,主要原因是______.
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池(如图2)中,氢和氮在电极上合成了氨,且转化率达到了78%.则:阳极反应为______,阴极反应为______.
参考答案:(1)根据工业生产中,氮气来自空气,氢气来自水和碳氢化合物,故答案为:空气;水和碳氢化合物;
(2)工业上在合成氨的过程中,必须对原料进行净化,防止催化剂铁触媒中毒,而减小催化活性,故答案为:防止催化剂中毒;
(3)合成氨的设备依次有:压缩机、合成塔、冷凝器、氨分离器、循环压缩机,故答案为:冷凝器;循环压缩机;
(4)合成氨的过程中,为保障反应速率和限度较大、催化剂的活性大,要选择适宜的温度400-500℃,故答案为:此温度下催化剂的活性大;
(5)氢和氮在电极上合成了氨的电解池中,阳极是氢气发生失电子的氧化反应,即H2-2e-═H2↑,阴极是氮气发生得电子的还原反应,即N2+6e-+6H+═2NH3,故答案为:H2-2e-═2H+;N2+6e-+6H+═2NH3.
本题解析:
本题难度:一般