1、选择题 下列变化,加入氧化剂才能实现的是
A.Na2S→H2S
B.CO2→CO
C.FeO→Fe2O3
D.AlCl3→Al(OH)3
参考答案:C
本题解析:在氧化还原反应中氧化剂得到电子,有关元素的化合价降低。如果在反应中需要加入氧化剂才能实现,这说明该微粒是还原剂,失去电子,有关元素的化合价升高,据此可以判断。A、在转化Na2S→H2S中元素的化合价均不变,不是氧化还原反应,加入酸即可实现,A不正确;B、在反应CO2→CO中碳元素的化合价由+4价降低到+2价,需要得到电子,因此需要加入还原剂才能实现,B不正确;C、在反应FeO→Fe2O3中铁元素的化合价由+2价升高到+3价,失去电子,因此需要加入氧化剂才能实现,C正确;D、在反应AlCl3→Al(OH)3中元素的化合价不变,不是氧化还原反应,通入氨气即可,D不正确,答案选C。
本题难度:一般
2、填空题 已知盐酸参加的下列三个反应:
① CaCO3+2HCl=CaCl2+CO2↑+H2O
② Fe+2HCl=FeCl2+H2↑
③ MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。
(2)上述反应说明盐酸具有_______性,______性,_______性。
参考答案:(1)②③ ,③?(2)酸 , 氧化 ,还原(各1分)
本题解析:(1)有电子转移的化学反应是氧化还原反应,失电子化合价升高的反应物是还原剂。①CaCO3+2HCl=CaCl2+CO2↑+H2O中,各元素化合价都不变,所以不是氧化还原反应,为复分解反应;②Fe+2HCl=FeCl2+H2↑中,铁失电子化合价升高,盐酸中氢元素得电子化合价降低,所以该反应是氧化还原反应,盐酸作氧化剂;③MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③。
MnCl2+Cl2↑+2H2O中锰元素得电子化合价降低,氯元素失电子化合价升高,所以该反应是氧化还原反应,且盐酸是还原剂,故答案为:②③;③。
(2)根据各反应酸中各元素化合价变化来确定其性质。通过(1)知,①中盐酸起酸作用,②中盐酸作氧化剂,③中盐酸作还原剂和酸性的作用,所以上述反应说明盐酸具有酸性、氧化性和还原性。
本题难度:一般
3、选择题 下列化学用语的书写正确的是
A.乙酸的分子式:C2H4O2
B.乙醇的结构简式:C2H6O
C.F原子结构示意图: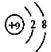
D.四氯化碳的电子式: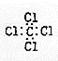
参考答案:A
本题解析:A、乙酸的分子式是C2H4O2,A正确;B、乙醇的结构简式是CH3CH2OH或C2H5OH,B不正确;C、F原子结构示意图为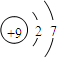 ,C不正确;D、四氯化碳的电子式是
,C不正确;D、四氯化碳的电子式是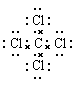 ,D不正确,答案选A。
,D不正确,答案选A。
本题难度:一般
4、填空题 有M、R、Q、V、W、X、Y、Z八种物质,它们之间存在如下关系:
①M+Y R?②R+H2O→NaOH+Y?③Q+NaOH→V+W+H2O?④X
R?②R+H2O→NaOH+Y?③Q+NaOH→V+W+H2O?④X W+Y
W+Y
⑤X+W+H2SO4 Q+Z+H2O。其中M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。
Q+Z+H2O。其中M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。
回答下列问题:
(1)写出各代号的化学式(或分子式)? M?,? R?,Q?,V?,W?,X?,Y?,Z?。
(2)写出下列有关化学反应的方程式和离子方程式,并标出电子转移方向和总数
反应③?,?;
反应⑤?,?。
参考答案:(1)Na、Na2O2、Cl2、NaClO、NaCl、NaClO3、O2、Na2SO4
(2)③?
⑤

本题解析:R+H2O→NaOH+Y,则R是钠或过氧化钠,由于R不是单质,所以R是过氧化钠,Y是氧气;M+Y R,知识M是钠。X
R,知识M是钠。X W+Y,作为X是氯酸钾或双氧水,由于W一定不是水,所以X是氯酸钠,则W是氯化钠。根据Q+NaOH→V+W+H2O、X+W+H2SO4
W+Y,作为X是氯酸钾或双氧水,由于W一定不是水,所以X是氯酸钠,则W是氯化钠。根据Q+NaOH→V+W+H2O、X+W+H2SO4 Q+Z+H2O以及Q是气体单质可知,Q应该是氯气,则V是次氯酸钠,Z是硫酸钠。
Q+Z+H2O以及Q是气体单质可知,Q应该是氯气,则V是次氯酸钠,Z是硫酸钠。
(1)由以上分析可知M、R、Q、V、W、X、Y、Z分别是Na、Na2O2、Cl2、NaClO、NaCl、NaClO3、O2、Na2SO4。
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,也是氧化还原反应,则可表示为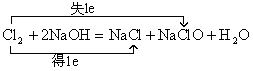 ,相应离子方程式可表示为
,相应离子方程式可表示为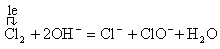 。在酸性条件下氯酸钠可以氧化氯化钠生成氯气,可表示为
。在酸性条件下氯酸钠可以氧化氯化钠生成氯气,可表示为 ,相应的离子方程式可表示为
,相应的离子方程式可表示为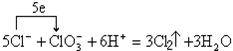 。
。
本题难度:一般
5、填空题 (5分)图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
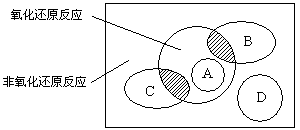
(1)若图中B圈表示化合反应,则C圈表示________反应(填基本反应类型,下同),A圈表示________反应,D圈表示________反应。
(2)B圈、C圈分别与氧化还原反应重叠的阴影部分用化学方程式各举出一例:
__________________________________;_________________________________。
参考答案:(5分)(1)分解反应,置换反应,复分解反应。
(2)Cl2+2FeCl2 2FeCl3;2KClO3
2FeCl3;2KClO3 2KCl+3O2↑(其它正确答案也得分)
2KCl+3O2↑(其它正确答案也得分)
本题解析:(1)凡是有元素化合价升降的反应都是氧化还原反应,所以复分解反应一定不是氧化还原反应,而置换反应一定是氧化还原反应。因此若图中B圈表示化合反应,则C圈表示分解反应,A圈表示置换反应反应,D圈表示复分解反应。
(2)有单质参加的化合反应或有单质生成的分解反应都是氧化还原反应,例如Cl2+2FeCl2 2FeCl3、2KClO3
2FeCl3、2KClO3 2KCl+3O2↑。
2KCl+3O2↑。
点评:判断氧化还原反应的依据是化合价的升降,而电子的得失是氧化还原反应的本质。所以判断氧化还原反应的关键是准确标出有关元素的化合价,然后分析即可。
本题难度:一般