1、选择题 下列过程中,需要加快化学反应速度的是( )
A.钢铁腐蚀
B.食物变质
C.金属冶炼
D.塑料老化
参考答案:为避免材料的浪费和资源的损耗,钢铁腐蚀、食物变质以及塑料老化,应降低反应速率,而冶炼金属,为提高产量,应增大反应速率.
故选C.
本题解析:
本题难度:一般
2、选择题 下列说法不正确的是
[? ]
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
参考答案:C
本题解析:
本题难度:一般
3、选择题 设C+CO2 2CO(正反应吸热),正反应的反应速率为v1;N2+3H2
2CO(正反应吸热),正反应的反应速率为v1;N2+3H2 2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(正反应放热),正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
A.v1减小,v2增大
B.同时减小
C.v1增大,v2减小
D.同时增大
参考答案:D
本题解析:温度升高会使反应速率增大。
本题难度:一般
4、选择题 对于密闭容器中进行的反应N2(g)+O2(g)?2NO(g),下列条件能加快其反应速率的是( )
A.增大体积使压强减小
B.体积不变,充入N2使压强增大
C.体积不变,充入He使压强增大
D.压强不变,充入气体Ne
参考答案:A.增大体积,反应物的浓度减小,单位体积活化分子的数目减少,反应速率减慢,故A错误;
B.体积不变充入N2使压强增大,对于反应N2+O2?2NO,氮气为反应物,反应物的浓度增大,活化分子的数目增多,反应速率增大,故B正确;
C.体积不变充入He使压强增大,但对于反应N2+O2?2NO,充入He参加反应的物质的浓度不变,活化分子的数目不变,反应速率不变,故D错误;
D.压强不变充入He,相当于是增大体系的体积,反应物的浓度减小,活化分子的数目减少,反应速率减慢,故D错误.
故选B.
本题解析:
本题难度:简单
5、填空题 (1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应?
蔗糖水解:?
CH3CH(OH)CH3的催化氧化:?
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI?Ⅱ.2HI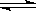 H2+I2?Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2?Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)=?

(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是?(填序号)
a.加入浓硝酸?b.加入少量CuSO4固体? c.用粗锌代替纯锌
d.加热? e.把锌粒弄成锌粉? f.用98.3%浓硫酸
参考答案:(1)(每小题3分,共6分)
3CH3COOH+CH2OHCHOHCH2OH
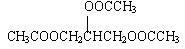 +3H2O
+3H2O

2CH3CHOHCH3+O2 2CH3COCH3+2H2O
2CH3COCH3+2H2O
(2)(4分)(1)0.1mol/(L·min)---2分,?(2)a、f--2分
本题解析:(1)甘油中含有3个羟基,所以和乙酸发生酯化反应,消耗3分子乙酸。蔗糖是二糖,水解生成葡萄糖和果糖。2-丙醇中和羟基相连的碳原子上只有1个氢原子,催化氧化的产物是丙酮。
(2)根据图像可知,平衡时氢气的物质的量是0.1mol,所以消耗碘化氢是0.2mol,因此其反应速率是 。
。
(3)考查外界条件对反应速率的影响。浓硝酸和浓硫酸都是氧化性酸,和锌反应生成物不是氢气。b和c中可以构成原电池,反应速率可以加快。温度升高,反应速率加快。e是增大反应物的接触面积,反应速率加快。所以答案选af。
本题难度:一般