| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《影响化学反应速率的因素》高频考点特训(2019年练习版)(十)
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。 (1)t1~t2这段时间内的化学反应速率v(H2)= 。? (2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。? (3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。? 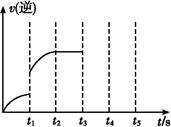 参考答案:(Ⅰ)(1)C(s)+H2O(g) 本题解析:(Ⅰ)(1)根据化学平衡常数的定义,找出反应物、生成物以及系数,写出方程式C(s)+H2O(g) 本题难度:一般 2、实验题 草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快。某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究。
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
(1)实验Ⅰ得出的结论是_____。 (2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。 ①温度对该反应速率有影响 ②硫酸对草酸和KMnO4溶液的反应有影响 ③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小 ④在酸性范围内,pH值越小对反应越有利[ (3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。 (4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为: 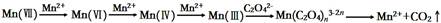 上述实验中,实验_____可证明这个历程是可信的。 参考答案:(1)Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率。(2)①②③; 本题解析:(1)未加MnSO4的试管褪色需要30 s,加MnSO4的试管褪色需要2 s.说明Mn2+能够加快反应速率。在反应中起到催化剂的作用。(2)加入10滴稀硫酸的试管在室温下褪色需要90s,放置在温度为65℃的水浴中加热的褪色时间需要70s,说明温度对该反应速率有影响;在室温下未滴加稀硫酸的试管褪色需要100 s,滴加稀硫酸的试管褪色需要90s。说明硫酸对草酸和KMnO4溶液的反应有影响;同样放置于温度为65℃的水浴中分别加入10滴稀硫酸加热,加入1 mL稀硫酸加热,加入2 mL稀硫酸加热,褪色时间分别是70s、 100s、 120s,则说明加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小;在酸性条件下,溶液的酸性越小,对反应越有利,溶液的酸性越大,对反应反而不利。结论正确的是①②③。(3)草酸溶液与酸性KMnO4溶液发生氧化还原反应的离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;在滴定时通常是用已知浓度的物质来滴定未知浓度的物质。所以未知浓度H2C2O4在锥形瓶中,已知浓度的KMnO4在酸式滴定管中。滴定终点时溶液的颜色从无色变为浅紫红色,且在半分钟内不褪色。在滴定完成后若仰视读取KMnO4溶液,则KMnO4标准溶液体积偏大,以此为标准进行计算求出的草酸的浓度就会偏大。(4)实验Ⅰ是证明Mn2+对反应的催化作用。实验Ⅱ是证明溶液的酸碱性对反应的影响。实验Ⅲ是证明温度对反应的影响。通过这些分析可知实验Ⅰ可证明这个历程是可信的。2C2O4)溶液与酸性KMnO4溶液反应的影响的知识。 本题难度:一般 3、选择题 在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g) 参考答案:D 本题解析:两种状态是等效平衡,该恒容恒温下有两种情况,一种是x=3,一种是x=2的全等平衡,前一种压强不影响平衡,后一种压强增大平衡正向移动。A、压强增大,两种情况C浓度增大,错误;B、第一种体积分数不变,后一种变大,错误;C、第一种不变,错误;D、增大压强,正逆反应速率均增大,正确。 本题难度:困难 4、选择题 下列实验中,可以加快反应速率的是:(? ) 参考答案:B 本题解析:考查外界条件对反应速率的影响。一般情况下,反应物的浓度越大、温度越高、使用催化剂、通过原电池反应或增大反应物的接触面积,都可以使反应速率加快。水是纯液体,增加水的量,不能改变反应速率。A不正确。选项B中能形成铜锌原电池,锌作负极,加快反应速率,正确。C中浓硫酸和铝发生钝化,不能生成氢气,不正确。通入氦气,并没有改变反应物或生成物的浓度,反应速率不变,所以答案选B。 本题难度:一般 5、填空题 (8分)在体积不变的密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应: 参考答案:(8分)(1)增大;(2)增大(3)增大;(4)不变 本题解析:(1)升高温度,增大活化分子的百分数,反应速率增大; 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《有关氧化还.. | |