1、选择题 下列物质在一定条件下均能产生氧气,其中最适宜用于呼吸面具中供氧的是( )
A.HNO3
B.H2O2
C.KClO3
D.Na2O2
参考答案:D
本题解析:
本题难度:一般
2、选择题 对下列事实的解释正确的是( ? )
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
参考答案:A
本题解析:
本题难度:简单
3、简答题 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
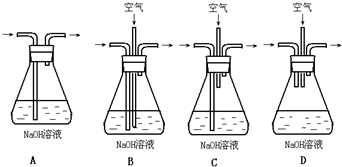
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为______;为了吸收该反应中产生的尾气,请选择下列中合适的装置______.
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol?L-1,就认为沉淀完全),然后过滤、浓缩、结晶.
已知:Ksp[Cu((OH)2]≈10-22,Ksp[Fe((OH)2]≈10-16,Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是______.
②为了使铁元素全部沉淀,应调节pH至少为______.
③方案2中甲物质可选用的是______.
A、CaO?B、NaOH?C、CuCO3?D、Cu2(OH)2CO3?E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因______.
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL?1.5mol?L-1的稀硫酸中,控温在50℃.加入18mL?10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O?10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是______,
⑥本实验CuSO4?5H2O的产率为______.
参考答案:(1)验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,依据离子反应实质,氢离子是硝酸和硫酸共同提供,氢离子分析可知最佳比为6:2,所以硫酸和硝酸物质的量之比最佳为3:2;吸收该反应中产生的尾气氮的氧化物需要通入氧气混合后通入氢氧化钠溶液被完全吸收;
A、一氧化氮不能被氢氧化钠吸收,故A错误;
B、空气和一氧化氮通入氢氧化钠溶液可以被吸收,故B正确;
C、空气未通入氢氧化钠溶液,一氧化氮不能再溶液中和氧气反应杯氢氧化钠吸收,故C错误;
D、气体都未通入氢氧化钠溶液中,不能被吸收,故D错误;
故答案为:3:2;B;
(2)①固体在空气中灼烧需要高温应在坩埚内完成,故答案为:坩埚;?
②Ksp[Fe((OH)3]≈10-38 ,依据沉淀溶解平衡可知,c(Fe3+)×c3(OH-)=10-38,一般认为铁离子的浓度下降到10-5mol?L-1,
c(OH-)=10-11mol/L,c(H+)=10-3mol/L,pH=3,故答案为:3;?
③除杂的原则,保证不引入杂质,加入氧化铜或碱式碳酸铜都能能和酸反应提高溶液PH,但不引进新的杂质,加入CaO、NaOH、Fe2(SO4)3会引入新的杂质离子,得不到纯净的硫酸铜晶体,故答案为:CD;
④反应中加入少量FeSO4可加速铜的氧化,亚铁离子酸性溶液中被空气中的氧气氧化为铁离子,铁离子溶解铜生成氯 化铁和氯化铜,反应的两种方程式为:4Fe2++O2+4H+═4Fe3++2H2O; 2Fe3++Cu═2Fe2++Cu2+,故答案为:4Fe2++O2+4H+═4Fe3++2H2O,2Fe3++Cu═2Fe2++Cu2+;
⑤过氧化氢不稳定,温度过高易分解生成水和氧气,故答案为:防止双氧水分解;
⑥设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4?5H2O
64g? 250g
3.2g? xg
所以x=12.5
理论上生成CuSO4?5H2O 12.5克,故产率为10.6g12.5g×100%=84.8%,
故答案为:84.8%.
本题解析:
本题难度:一般
4、填空题 下列各反应表明了HNO3的什么性质?
①NaNO3(s)+H2SO4(浓) NaHSO4+HNO3↑_________
NaHSO4+HNO3↑_________
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O_________
③C+4HNO3(浓) 4NO2↑+CO2↑+2H2O_________
4NO2↑+CO2↑+2H2O_________
④Na2CO3+2HNO3=2NaNO3+CO2↑+H2O_________
⑤4HNO3 2H2O+4NO2↑+O2↑_________
2H2O+4NO2↑+O2↑_________
参考答案:①挥发性;②氧化性、酸性;③氧化性;④强酸性;⑤不稳定性
本题解析:
本题难度:一般
5、选择题 在pH=1的某溶液中,可能存在NO3-、I-、Fe3+中的一种或两种,向该溶液中滴入Br2,单质Br2被还原,由此推断该溶液里,上述三种离子中一定存在的离子为
[? ]
A.NO3-、Fe3+?
B.只有NO3-?
C.I-、Fe3+?
D.只有I-
参考答案:D
本题解析:
本题难度:简单