1、选择题 已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确盼是( )
| 酸 | 电离平衡常数
醋酸
Ki=1.75×10-5
次氯酸
Ki=2.98×10-8
碳酸
Ki1=4.30×10-7
Ki2=5.61×10-11
亚硫酸
Ki1=1.54×10-2
Ki2=1.02×10-7
|
A.将0.1?mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小
B.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
C.少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是NaClO
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列事实可证明氨水是弱碱溶液的是(? )。
A.氨水能被弱酸醋酸中和
B.铵盐受热易分解
C.氨水可以使酚酞试液变红
D.0.lmol/L氯化铵溶液的pH约为5
参考答案:D
本题解析:A、只能说明氨水是碱溶液,错误;B、铵盐受热易分解说明铵盐对热不稳定,错误;C、氨水可以使酚酞试液变红,说明氨水显碱性,错误;D、0.lmol/L氯化铵溶液的pH约为5,溶液显酸性,说明铵根离子水解生成了弱碱NH3·H2O,使溶液中的c(H+)>c(OH-),正确,答案选D。
本题难度:简单
3、选择题 下列说法正确的是
A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大
B.某溶液中由水电离出的 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液
中: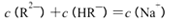
D.相同物质的量浓度的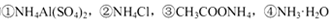 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
参考答案:D
本题解析:A、向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)不变,错误;B、如果该溶液为碱的溶液,水电离出的c(H+)=1.0×10-a mol?L?1,该溶液的pH为a,错误;C、根据电荷守恒可得:c(Na+)+c(H+)=c(OH?)+2c(R2-)+c(HR-),pH等于7,则c(H+)=c(OH?),所以c(Na+)= +2c(R2-)+c(HR-),错误;D、NH4Al(SO4)2中NH4+与Al3+的水解相互抑制,CH3COONH4中CH3COO?与NH4+的水解相互促进,NH3?H2O为弱碱,电离出少量的NH4+,所以c (NH4+)由大到小的顺序是:①>②>③>④,正确。
本题难度:一般
4、选择题 20 ℃时H2S饱和溶液1 L,其浓度为0.1 mol·L-1,已知其电离方程式为H2S H++HS-,HS-
H++HS-,HS- H++S2-,若要使该溶液H+及S2-浓度都减小,可采取的措施是?
H++S2-,若要使该溶液H+及S2-浓度都减小,可采取的措施是?
A.通入适量的HCl
B.加入适量的NaOH固体
C.通入适量的SO2
D.加入适量的CuSO4固体
参考答案:C
本题解析:A、溶液已经饱和,再通入氯化氢气体抑制氢硫酸的电离,但氯化氢气体溶于水得到强酸,所以氢离子浓度增大,硫离子浓度减小,所以不符合,故A错误;B、氢硫酸和氢氧化钠反应生成硫化钠和水,反应方程式为:H2S+2NaOH=Na2S+H2O,所以加入氢氧化钠后促进氢硫酸的电离,使硫离子浓度增大,氢离子浓度减小,所以B不符合,故B错误;C、通入适量的SO2抑制水的电离,但导致溶液中氢离子浓度和硫离子浓度都减小,所以符合,故C正确;D、氢硫酸和硫酸铜的反应方程式为:H2S+CuSO4=CuS↓+H2SO4,弱酸变成强酸溶液,溶液的PH值减小,硫离子和铜离子生成硫化铜沉淀导致硫离子浓度降低,所以D不符合,故D不正确.
本题难度:一般
5、填空题 可以用电离度和电离平衡常数描述弱电解质的电离情况,下表是常温下几种弱酸的电离平衡常数(Ka)和弱 碱的电离平衡常数(Kb)。

请回答下列问题:
(1)上述四种酸中,酸性最弱的是____(填化学式)。下列能使醋酸溶液中CH3COOH的电离程度增大,而 电离平衡常数不变的操作是____(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2) CH3COONH4的水溶液呈___(填“酸性”、“中性”或“碱性”),理由是___ ,
溶液中各离子浓度的大小关系是___。
参考答案:(1)HCN;B
(2)中性; CH3COOH与NH3·H2O的电离平衡常数相等,可知CH3COO -和NH4+在浓度相等时的水解程度相同; c( NH4+) =c(CH3COO -)>c(H+)=c(OH -)
本题解析:
本题难度:一般