1、选择题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表:
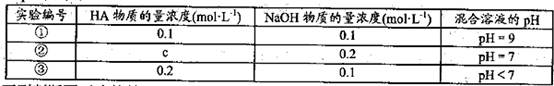
下列判断不正确的是
A.HA的电离方程式为: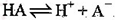
B.不考虑其他组的实验结果,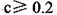
C.③组实验中,混合溶液中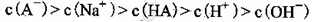
D.①组实验中,混合溶液中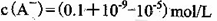
参考答案:D
本题解析:A、由①一元酸与一元强碱等体积混合,溶液呈碱性,说明该酸为弱酸,所以HA的电离方程式正确;B、不考虑其他组的实验结果,与氢氧化钠等体积混合溶液呈中性时,说明若酸为强酸则c=0.2,若酸为 弱酸则酸过量,c>0.2,所以c≥0.2,正确;C、③组中,溶液呈酸性,所得溶液为NaA和HA的混合液,酸的电离大于酸根离子的水解程度,所以离子浓度的大小关系是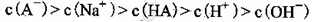 ,正确;D、根据物料守恒和质子守恒得c(A-)=(0.05+10-9-10-5)mol/L,错误,答案选D。
,正确;D、根据物料守恒和质子守恒得c(A-)=(0.05+10-9-10-5)mol/L,错误,答案选D。
本题难度:一般
2、选择题 已知难溶性的硫酸铅与醋酸铵溶液反应得到无色澄清溶液,反应的离子方程式是PbSO4+2CH3COO-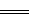 (CH3COO)2Pb+
(CH3COO)2Pb+ ,据此判断醋酸铅是
,据此判断醋酸铅是
A.易溶强电解质
B.易溶弱电解质
C.难溶强电解质
D.难溶弱电解质
参考答案:B
本题解析:
PbSO4+2CH3COONH4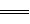 (CH3COO)2Pb+(NH4)2SO4属于复分解反应,使其反应至少需要满足下列三个条件中的一个:有难溶性物质(如沉淀)、挥发性物质(如气体)、难电离物质(如水)。(NH4) 2SO4是可溶性盐,(CH3COO)2Pb是无色澄清溶液,所以(CH3COO)2Pb必定是难电离物质,即弱电解质,在书写离子方程式时应保留化学式的形式。选B。
(CH3COO)2Pb+(NH4)2SO4属于复分解反应,使其反应至少需要满足下列三个条件中的一个:有难溶性物质(如沉淀)、挥发性物质(如气体)、难电离物质(如水)。(NH4) 2SO4是可溶性盐,(CH3COO)2Pb是无色澄清溶液,所以(CH3COO)2Pb必定是难电离物质,即弱电解质,在书写离子方程式时应保留化学式的形式。选B。
本题难度:一般
3、选择题  在一定温度下,HCN在水中存在电离平衡:HCN
在一定温度下,HCN在水中存在电离平衡:HCN H+ + CN-。下列说法错误的
H+ + CN-。下列说法错误的
 通入HCl气体,Q>K,平衡逆向移动
通入HCl气体,Q>K,平衡逆向移动
升高温度,溶液pH减小
 稀释溶液,电离平衡常数减小
稀释溶液,电离平衡常数减小
D.加入NaCN固体,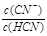 增大
增大
参考答案:C
本题解析:
答案:C
A、正确,通入HCl气体,H+浓度增大,平衡逆向移动;
B、正确,电离是吸热反应,升高温度,平衡正向移动,H+浓度增大,溶液pH减小
C、不正确,稀释溶液,电离平衡常数不变;
D、正确,CN―浓度增大的幅度大于HCN。
本题难度:简单
4、选择题 用水稀释0.1mol·L-1 氨水时,溶液中随着水量的增加而减小的是( )
A.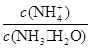
B.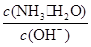
C.c(H+)×c(OH-)
D.OH-的物质的量