1、选择题 由可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是?(?)

A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应
参考答案:BD
本题解析:由图像可知,压强增大,生成物在平衡混合物中的百分含量减小,说明增大压强,平衡向逆反应方向移动,增大压强,平衡向气体系数和减小的方向移动,故逆反应是气体系数和减小的方向,故生成物中一定有气体,B正确,A错误;由图像可知,升高温度,生成物在平衡混合物中的百分含量增大,说明升高温度,平衡向正反应方向移动,升高温度,平衡向吸热反应方向移动,故正反应为吸热反应,D正确,C错误;故选BD。
本题难度:一般
2、选择题 在一定条件下将1mol的CO和1mol H2O(g)放入密闭容器中发生反应:CO(g)+H2O(g) 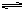 CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
A.小于0.6mol大于0.4mol
B.等于1mol
C.大于0.6mol,小于1mol
D.大于1mol
参考答案:C
本题解析:达到平衡后再通入4mol H2O(g),增大反应物浓度,平衡正向移动,所以CO2的物质的量增加,大于0.6mol。但作为可逆反应,反应物不能全部转化,所以“1mol的CO”不能完全反应,故CO2的物质的量小于1mol。故选C
本题难度:简单
3、选择题 已知2SO2 (g) + O2 (g)  2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙 > 2P乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
D.反应放出或吸收热 量的数值Q:Q甲=Q丙 > 2Q乙
参考答案:B
本题解析:恒温恒容,甲与乙起始n(SO2):n(O2)=2:1,甲为在乙的基础上增大一倍压强,平衡向正反应移动,转化率增大;丙按化学计量数转化到左边可得n(SO2)=2mol,n(O2)=1mol,与甲为等效平衡,平衡时对应个组分的物质的量相等。A、甲与丙为等效平衡,平衡时对应个组分的物质的量相等,故压强P甲=P丙,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,故P乙<P甲<2P乙,故P甲=P丙<2P乙,故A错误;B、甲与丙为等效平衡,平衡时对应个组分的物质的量相等,故压强m甲=m丙,甲等效为在乙到达平衡的基础上,再加入1mol?SO2和0.5mol?O2,增大压强,平衡向正反应移动,SO2转化率增大,m甲>2m乙,故m甲=m丙>2m乙,故B正确;C、对于甲、乙,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故k甲=k丙=k乙=2:1,故C错误;D、甲与丙为等效平衡,平衡时对应个组分的物质的量相等,故Q甲+G丙=197,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,SO2转化率增大,故Q甲>2Q乙,故D错误。
本题难度:一般
4、选择题 一定条件下,反应:6H2 + 2CO2 C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。
 ?
?
下列说法正确的是
A.该反应的△H > 0
B.达平衡时,v(H2)正 = v(CO2)逆
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90 %
参考答案:D
本题解析:A、温度升高,二氧化碳的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应,该反应的△H <0,错误;B、氢气与二氧化碳的物质的量比是3:1,所以达平衡时,v(H2)正 ="3" v(CO2)逆 ,错误;C、该反应是放热反应,所以升高温度平衡常数K值减小,b点温度高于c点,则b点对应的平衡常数K值小于c点,错误;D、氢气与二氧化碳的物质的量比是3:1,a点的二氧化碳的平衡转化率是60%,曲线I:n(H2):n(CO2)=2,则氢气的平衡转化率是60%×3/2=90%,正确,答案选D。
本题难度:一般
5、填空题 . (14分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃
| 700
| 900
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的平衡常数表达式K=??,△H?0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)=??mol·L-1, C的物质的量为?mol;若反应经一段时间后,达到平衡时A的转化率为?,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为?;
(3)判断该反应是否达到平衡的依据为?(填正确选项前的字母):?
a.压强不随时间改变? b.气体的密度不随时间改变
c. c(A)不随时问改变? d.单位时间里生成c和D的物质的量相等?
(4)1200℃时反应C(g)+D(g) ?A(g)+B(g)的平衡常数的值为?。
?A(g)+B(g)的平衡常数的值为?。
参考答案:(共14分)
(1)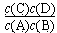 ? <?(每空1分,共2分)
? <?(每空1分,共2分)
(2)0.022 mol·L-1?0.09mol? 80%? 80%?(每空2分,共8分)
(3)? c(2分)
(4) 2.5(2分)
本题解析:(1)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数表达式K=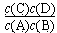 。根据表中数据可知,升高温度,平衡常数减小。这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应,即△H<0。
。根据表中数据可知,升高温度,平衡常数减小。这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应,即△H<0。
(2)6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则消耗A的浓度是0.018mol/L。A的起始浓度是0.20mol÷5L=0.04mol/L,所以此时A的浓度是0.04mol/L-0.018mol/L=0.022mol/L。根据方程式可知,C的物质的量浓度是0.018mol/L,所以C的物质的量是0.018mol/L×5L=0.09mol;设A的转化率是x,则平衡时ABCD的物质的量分别是(0.2-0.2x)mol、(0.8-0.2x)mol、0.2xmol、0.2xmol。根据平衡常数表达式可知0.2x×0.2x=(0.2-0.2x)×(0.8-0.2x),解得x=0.8,即转化率是80%;如果这时向该密闭容器中再充入1 mol氩气,则平衡不移动,转化率不变。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项c正确;反应前后体积不变,因此压强始终是不变的,a不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确;d中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此d中的关系始终是成立,不正确,答案选c。
(4)逆反应的平衡常数是正反应平衡常数的倒数,因此该反应的平衡常数是1÷0.4=2.5。
本题难度:一般