1、选择题 下列说法正确的是(?)
A.非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
参考答案:A
本题解析:A. 在任何化合物中正负化合价的代数和为0.因为O的化合价是负价,Na的化合价为+1价,所以非金属元素R所形成的含氧酸盐(NaROb)中的R元素必定呈现正价。正确。B.非金属和金属元素都可以形成含氧酸或含氧酸盐。如H2CO3、Na2CO3;HMnO4、KMnO4等。错误。C. 有些非金属元素如O、F由于非金属性很强,不能生成不同价态的含氧酸。错误。D.不是所有的非金属的最高价含氧酸都具有强氧化性。如H2CO3、H3PO4无强氧化性。错误。
本题难度:一般
2、选择题 一定量的KMnO4与足量的250mL浓盐酸反应,方程式为2KMnO4 + 16HCl(浓) =" 2KCl" + 5Cl2↑ + 2MnCl2 + 8H2O,反应结束后,共转移电子为5mol,则还原产物中,阳离子的物质的量浓度为(溶液的体积变化忽略不计)
A.10mol/L
B.2mol/L
C.4mol/L
D.8mol/L
参考答案:C
本题解析:方程式为2KMnO4 + 16HCl(浓) =" 2KCl" + 5Cl2↑ + 2MnCl2 + 8H2O中,氧化剂为KMnO4,反应后生成的MnCl2为还原产物,当有2mol KMnO4完全反应,则共转移电子为10mol,若反应结束后,共转移电子为5mol,则还原产物MnCl2的物质的量为1mol,即可得阳离子的物质的量浓度为4mol/L?;
本题难度:一般
3、选择题 对下列实验现象的解释不正确的是( )
| 选项 | 实验现象 | 解释
A
Cl2使鲜艳的红色花瓣褪色
Cl2具有强还原性
B
NH3与HCl气体接触时有白烟产生
NH3与HCl反应生成固体小颗粒
C
新切开的Na表面在空气中很快变暗
Na容易与空气中的氧气等反应
D
氯化铝溶液中滴入过量的氢氧化钠溶液,白色沉淀溶解
氢氧化铝具有两性
|
A.A
B.B
C.C
D.D
参考答案:A.氯气与水反应可生成具有漂白性的次氯酸,能使红色花瓣褪色,但氯气本身不能使有色物质褪色,与氯气的强氧化性无关,故A错误;
B.NH3与HCl反应生成氯化铵固体,可观察到白烟生成,故B正确;
C.Na容易与空气中的氧气生成白色的氧化钠固体,颜色由银白色变成白色,可观察到变暗,故C正确;
D.氢氧化铝为两性氢氧化物,可用氢氧化钠等强碱反应,故D正确.
故选A.
本题解析:
本题难度:简单
4、选择题 下列表述正确的是(?)
A.向氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度
B.NH3是一种碱,能使湿润的红色石蕊试纸变蓝
C.少量的CO2通入BaCl2溶液中会产生白色沉淀
D.SO2能使酸性高锰酸钾溶液褪色,是因为SO2具有漂白性
参考答案:A
本题解析:选项A:Cl2+H2O=HCl+HClO,向氯水中加入碳酸钙粉末,CaCO3+HCl=CaCl2+H2CO3,从而使反应平衡向生成HClO的方向移动,提高溶液中HClO的浓度;选项B:NH3不是碱,只有氨水才能电离出氢氧根使红色石蕊试纸变蓝;选项C:CO2通入BaCl2水溶液与水反应生成碳酸,但碳酸酸性比盐酸弱,不能发生如下反应H2CO3+BaCl2=BaCO3↓+HCl(不符合强酸制弱酸规律);选项D:使酸性高锰酸钾褪色的是二氧化硫与水生成的亚硫酸,SO2不具备漂白性。
点评:中等题型,熟记课本相关基本知识的基础上加以判断。
本题难度:简单
5、选择题 卤族元素随原子核电荷数的增加,下列叙述不正确的是()
A.原子半径依次增大
B.元素的非金属性依次减弱
C.单质的氧化性依次减弱
D.氢化物的稳定性依次增强
参考答案:D
本题解析:卤族元素随着原子核电荷数的增加,电子层数逐渐增加,因此原子半径逐渐增大;因此原子核对最外层电子的吸引力逐渐减弱,元素的原子得电子的能力逐渐减弱,因此元素的非金属性逐渐减弱,单质的氧化性逐渐减弱。具体表现为:①与氢气发生化合反应:由易到难(反应由F2与H2不需要任何条件,到H2与I2加热才化合,并且化合生成的HI同时分解),生成氢化物的稳定性逐渐减弱。当它们的氢化物溶于水时,溶液酸性逐渐增强就成为必然。②卤素单质与水的反应由易到难:F2与水剧烈反应,生成氟化氢和氧气,而I2与水只能微弱反应。③卤素单质之间能发生置换反应:Cl2+2Br-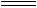 2Cl-+Br2,Br2+2I-
2Cl-+Br2,Br2+2I-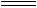 2Br-+I2,Cl2+2I-
2Br-+I2,Cl2+2I-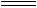 2Cl-+I2。此题答案为D。
2Cl-+I2。此题答案为D。
本题难度:简单