1、简答题 FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
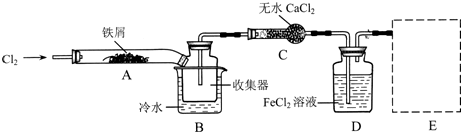
①检验装置的气密性:
②通入干燥的Cl2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为?.
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是?.
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)?.
(4)装置B中冷水浴的作用为?;装置C的名称为?;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:?.
(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为?.
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为?.
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②?.
参考答案:
本题解析:
本题难度:一般
2、填空题 把一装满氯气的试管倒立在滴有酚酞溶液的NaOH溶液中,摇动试管。请描述现象并解释原因。
现象:
(1)?。
(2)?。
原因:
(1)?。
(2)?。
参考答案:现象:(1)溶液红色逐渐褪去
(2)液体沿试管内壁上升到一定高度,最终上部空间的气体颜色会消失,剩余少量空气
原因:(1)Cl2与NaOH反应生成NaClO,NaClO有漂白性,使酚酞红色褪去(2)Cl2与NaOH反应,使试管内压强减小,大气把NaOH溶液压入试管
本题解析:(1)由于发生反应:C来源:91exam .orgl2+2NaOH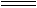 NaCl+NaClO+H2O,从而使NaOH减少;同时,生成的NaClO具有漂白作用使酚酞红色褪去。
NaCl+NaClO+H2O,从而使NaOH减少;同时,生成的NaClO具有漂白作用使酚酞红色褪去。
(2)由于氯气减少,试管内气体压强减小,外界大气压大于试管内部大气压,NaOH溶液被压入试管内。
本题难度:简单
3、选择题 检验集气瓶中氯气是否充满的正确方法是
A.干燥的碘化钾淀粉试纸放在瓶口
B.湿润的酚酞试纸,放于瓶口
C.用蘸有氢氧化钠溶液的玻璃棒放在瓶口
D.用湿润的碘化钾淀粉试纸放在瓶口
参考答案:D
本题解析:A.干燥的碘化钾淀粉试纸与氯气不反应,故不能检验;B.Cl2水显酸性,酚酞无色,所以湿润的酚酞试纸放于瓶口不能检验;C.同B,无现象;D.变蓝色,故正确.
本题难度:一般
4、选择题 下列说法中错误的是
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.制成0.5 L 1 mol·L-1的盐酸,需要氯化氢气体11.2 L(标准状况)
C.0.5 L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.配制2.0 mol/L的盐酸时,将量取的浓盐酸放入容量瓶中加水稀释
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列说法正确的是
A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色
B.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶
D.氯水经光照有气泡逸出,该气体为HCl
参考答案:C
本题解析:A错,久置的氯水为稀盐酸,滴入紫色石蕊试液,溶液只变红不褐色;B错,漂白粉的主要成分是CaCl2和Ca(ClO)2,应密封保存;C正确;D错,氯水经光照有气泡逸出,该气体为氧气;
本题难度:简单