1、选择题 下列说法中,正确的是
A.所有主族 元素正化合价数等于它的族序数
元素正化合价数等于它的族序数
B.VIIA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子 具有相同的核外电子排布
具有相同的核外电子排布
D.前三周期元素中共有12种非金属元素(包括稀有气体元素)
参考答案:B
本题解析:略
本题难度:简单
2、填空题 四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
?
| W
| X
| Y
| Z
|
结构或性质
| 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物
| 焰色反应呈黄色
| 在同周期主族元素形成的简单离子中,离子半径最小
| 最高正价与最低负价之和为零
|
?
(1)Z在元素周期表中位于?族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是?(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是?(填序号)。
A.自然界中的含量? B.单质与酸反应时失去的电子数
C.单质与水反应的难易程度?D.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因:?,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是?。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有?(填序号)。
A.m、n ?B.m、y?C.n、y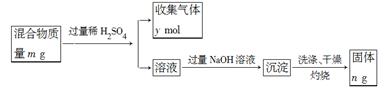
参考答案:(1)ⅣA?(2)Na ?(3)①C D?②电子层数相同,质子数Y > X
(4)HN3+NaOH=NaN3+H2O?(5)A B C
本题解析:根据题意可推出W是N;X是Na;Y是Al ;? Z 是Si 。(1)Si核外电子排布为2、8、4。所以它在元素周期表中位于第三周期第ⅣA。(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,这种物质是NaOH。则该元素是Na。(3)①Na、Al都是金属元素,可以通过其单质与水反应置换出氢的难易程度比较;也可以通过比较最高价氧化物对应水化物的碱性强弱。但不能看其原子失去电子的多少或自然界中的含量的多少。。因此选项为CD。②Na、Al都是第三周期的元素,原子核外的电子层数相同,但由于质数Al>Na。原子序数越大,原子半径就越小,原子失去电子就越难,元素的金属性就越弱。所以金属性Na >Al。(4)HN3酸性与醋酸相似,则它是弱酸。酸碱中和生成盐和水。则HN3与NaOH反应的方程式为HN3+NaOH=NaN3+H2O。(5) 有关反应的方程式为Mg+H2SO4=MgSO4+H2↑; 2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑;当加足量的NaOH溶液时发生反应:AlCl3+4NaOH= NaAlO2+3NaCl+2H2O; MgSO4+2NaOH= Mg(OH)2↓+Na2SO4。得到的沉淀是Mg(OH)2.将其过滤、洗涤、干燥后灼烧发生分解反应得到MgO。Mg(OH)2 MgO+H2O。A.根据MgO的质量n可计算出其中的Mg元素的质量,再用Mg、Al的总质量减去Mg元素的质量即得到Al的质量,从而求出Al的质量分数。正确。B.假设Mg、Al的物质的量分别为a、b。则根据题意可得24a+27b=m;a+3/2b=y.两式联立就可计算出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。C.根据MgO的质量n可计算出其中的Mg元素的质量,利用n=m/M计算出Mg的物质的量。根据Mg+H2SO4=MgSO4+H2↑知道其放出H2的物质的量。再用n(H2)(Al)=n(H2)(总)- n(H2)(Mg).根据2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。
MgO+H2O。A.根据MgO的质量n可计算出其中的Mg元素的质量,再用Mg、Al的总质量减去Mg元素的质量即得到Al的质量,从而求出Al的质量分数。正确。B.假设Mg、Al的物质的量分别为a、b。则根据题意可得24a+27b=m;a+3/2b=y.两式联立就可计算出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。C.根据MgO的质量n可计算出其中的Mg元素的质量,利用n=m/M计算出Mg的物质的量。根据Mg+H2SO4=MgSO4+H2↑知道其放出H2的物质的量。再用n(H2)(Al)=n(H2)(总)- n(H2)(Mg).根据2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。
本题难度:一般
3、填空题 短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
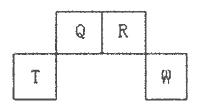
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为?(用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
参考答案:(1)第三周期ⅥA族;Al>C>N;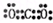 ;
;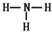 ;(2)弱于;(3)低;(4)金刚石;(5)⑦;⑥。
;(2)弱于;(3)低;(4)金刚石;(5)⑦;⑥。
本题解析:短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素;(1)W为S元素,原子核外有3个电子层,最外层电子数为6,处于周期表中第三周期ⅥA族;同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>C>N;Q的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对,其电子式为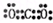 ;R气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其结构式为
;R气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其结构式为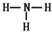 ,故答案为:第三周期ⅥA族;Al>C>N;
,故答案为:第三周期ⅥA族;Al>C>N;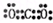 ;
;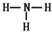 ;(2)非金属性S>C,故的电子能力S>C,故答案为:弱于;
;(2)非金属性S>C,故的电子能力S>C,故答案为:弱于;
(3)原子序数比R多8的元素形成的一种常见气态氢化物为PH3,PH3分子之间为范德华力,NH3分子之间存在氢键,最大分子间作用力,故PH3沸点低于NH3,故答案为:低;(4)四元素单质中属于原子晶体的是金刚石,故答案为:金刚石;(5)R为氮元素,最高化合价为+5、最大化合价为-3,原子半径小于P,故为⑦号元素;与Al同周期且最高价氧化物的水化物碱性最强的元素为Na,最后化合价为+1,短周期中原子半径最大,故为⑥号元素,故答案为:⑦;⑥。
本题难度:一般
4、填空题 根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式为:?。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的
外围电子排布是4s24p4,该元素的名称是?。
(3)根据VSEPR模型,H3O+的分子立体结构为:?。
(4)含有非极性键的离子化合物(任写一种)??。
(5)含有极性键和非极性键的极性分子(任写一种)?。
(6)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1∶1配合所得离子显红色.含该离子的配合物的化学式是?.
参考答案:(1)3d64s2? (2)硒 (3)三角锥形 (4)Na2O2? (5)H2O2? (6) [Fe(SCN)]Cl2
本题解析:(1)原子序数最小的第Ⅷ族元素是铁,则原子的外围电子排布式为3d64s2。
(2)根据外围电子排布是4s24p4可知,该元素是第四周期第ⅣA族元素硒。
(3)根据VSEPR模型,H3O+中中心原子含有的孤对电子对数=(6-1-3×1)÷2=1,所以H3O+的分子立体结构为三角锥形。
(4)含有非极性键的离子化合物可以是过氧化钠。
(5)含有极性键和非极性键的极性分子可以是双氧水。
(6)若Fe3+与SCN-以个数比1∶1配合所得离子显红色,这说明还必须结合2个氯离子,则含该离子的配合物的化学式是[Fe(SCN)]Cl2。
点评:该题是高考中的常见考点,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
5、选择题 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。下列说法不正确的是( )
A.常见化合物E2D2与水反应生成D的单质,同时生成的化合物溶于水能使酚酞试液变红
B.C的氢化物与C的最高价氧化物的水化物反应得到的产物中既有离子键又有共价键
C.D与A、B、C、E分别结合均能形成两种或两种以上的化合物
D.五种元素的原子半径按A~E的顺序依次增大
参考答案:D
本题解析:略
本题难度:简单