1、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)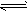 CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K与温度t的关系如下表:

回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______________。
(2)该反应为_____________反应(填“吸热”“放热”)。
参考答案:(1)K=[c(CO)·c(H2O)]/[c(CO2)·c(H2)]
(2)吸热
本题解析:
本题难度:一般
2、填空题 ⑴氢气是一种新型的绿色能源,又是一种重要的化工原料。氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出?142?.?9?kJ?热量。则能表示H2标准燃烧热的热化学方程式为________________________。
⑵燃料电池能量转化率高,具有广阔的发展前景。现用甲烷燃料电池进行右图所示实验:?
①该甲烷燃料电池中,负极的电极反应式为__________________。
②下图装置中,某一铜电极的质量减轻?6.4?g?,则?a?极上消耗的O2在标准状况下的体积为__________L。

⑶氢气是合成氨的重要原料,合成氨反应的化学方程式如下:
 ?
?
①?当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t3?时引起平衡移动的条件可能是______________其中表示平衡混合物中NH3的含量最高的一段时间是___________。

②温度为T℃时,将2amolH2和amolN2放入0?.?5L密闭容器中,充分反应后测得N2的转化率为50﹪。则反应的平衡常数为________________
③现以a?mol?NH3和足量空气为原料制取NH4NO3,经过一系列转化反应后,向反应混合物中加入bg水,得到密度为ρg/mL的溶液,计算该溶液中NH4NO3物质的量浓度的最大值。
参考答案:⑴H2(g)?+1/2O2(g)?==?H2O(l)?△H=-285.8kJ·mol-1
⑵①CH4?+?10OH--8e-?=?CO32-?+7H2O;②?1.12
⑶①加热;t2~t3;②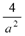 ;③500aρ/(49a+b)?mol/L
;③500aρ/(49a+b)?mol/L
本题解析:
本题难度:一般
3、填空题 PCl5的热分解反应如下:PCl5(g)?PCl3(g)+Cl2(g)
(1)该反应的平衡常数表达式为:K=______.
(2)若某温度下,在容积为1.0L的密闭容器中充入0.20mol?PCl5,达到平衡后,测得容器内PCl3的浓度为0.15mol/L,
①平衡时,PCl5的浓度为:______
②平衡时,Cl2的浓度为:______
③该温度下的平衡常数为:______.
(3)相同条件下,在容积为1.0L的密闭容器中充入0.20mol?PCl3和0.20mol?Cl2,达到平衡后,其平衡常数为:______.(保留两位小数)?
(4)某温度下,合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol在该温度下,将1mol?N2和3mol?H2放入密闭容器中,在有催化剂存在的条件下充分反应,测得反应放出的热量总是小于92.4kJ,其原因是:______.
参考答案:(1)可逆反应PCl5(g)?PCl3(g)+Cl2(g)的平衡常数k=c(PCl3)?c(Cl2)c(PCl5),
故答案为:c(PCl3)?c(Cl2)c(PCl5);
(2)平衡后PCl3的浓度为0.15mol/L,则:
? ? PCl5(g)?PCl3(g)+Cl2(g)
开始(mol/L):0.2? 0? 0
变化(mol/L):0.15? 0.15? 0.15
平衡(mol/L):0.05? 0.15?0.15
①由上述计算可知,平衡时,PCl5的浓度为0.05mol/L,
故答案为:0.05mol/L;
②由上述计算可知,平衡时,Cl2的浓度为0.15mol/L,
故答案为:0.15mol/L;
③故该温度下平衡常数k=c(PCl3)?c(Cl2)c(PCl5)=0.15×0.150.05=0.45,
故答案为:0.45;
(3)对于同一可逆反应,在相同温度下,正、逆两个过程的平衡常数互为倒数,故 PCl3(g)+Cl2(g)?PCl5(g),在相同温度下的平衡常数k=10.45=2.22,
故答案为:2.22;
(4)热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol表示1mol氮气(g)与3mol氢气(g)生成2mol氨气(g)反应的热量为92.4kJ,由于该反应是可逆反应,加入1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ,
故答案为:该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ.
本题解析:
本题难度:一般
4、简答题 下列说法正确的是( )
A.电离平衡常数受溶液浓度的影响
B.电离平衡常数可以表示弱电解质的相对强弱
C.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
D.H2CO3的电离常数表达式:K=
参考答案:A、电离平衡常数是温度的函数,与溶液浓度无关,故A错误;
B、电离平衡常数可以表示弱电解质的相对强弱,故B项正确;
C、酸中c(H+)既跟酸的电离常数有关,还跟酸的浓度有关,故C错误;
D、碳酸是分步电离的,第一电离常数表达式为:K1=C(H+)C(HCO3-)?C(H2CO3),第二步电离常数为:K2=C(H+)C(CO32-)C(HCO3-),故D错误.
故选:B.
本题解析:
本题难度:一般
5、填空题 在恒容密闭容器中进行反应: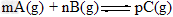 ,反应经5分钟达到平衡,测得此时A的浓度减小了a?mol/L,而C的浓度增加了2/3?a?mol/L,又知平均反应速率:v?(C)?=2v?(B)。(1)写出上述化学方程式中各物质的系数:m?=?______,n?=?_______,p?=?_______。
,反应经5分钟达到平衡,测得此时A的浓度减小了a?mol/L,而C的浓度增加了2/3?a?mol/L,又知平均反应速率:v?(C)?=2v?(B)。(1)写出上述化学方程式中各物质的系数:m?=?______,n?=?_______,p?=?_______。
(2)压强一定时,C的百分含量与温度、时间(T表示温度,t表示时间)的关系如图所示。

由此可知,该反应为________(填“吸热”或“放热”)反应。
(3)该反应的平衡常数表示式为____;升高温度,K值将___(填“增大”、“减小”或“不变”)。
(4)以下图1、图2均表示该反应在t1时达到平衡,在t2时改变某条件发生变化的曲线。
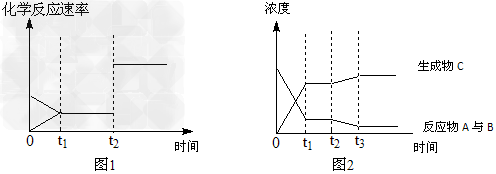
试判断,图1中t2时改变的条件是______________;图2中t2时改变的条件是____________。
参考答案:(1)3;1;2?
(2)放热
(3)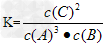 ;减小
;减小
(4)使用催化剂;降低温度
本题解析:
本题难度:一般