1、选择题 核内中子数为N 的R2+,质量数为A ,则m g 其氧化物中所含质子的物质的量为
A.m/A+16?(A – N + 8)mol
B.m/A+16?(A – N + 10)mol
C.(A – N - 2)mol
D.m/A (A – N + 6)mol
参考答案:A
本题解析:由R2+知其氧化物为RO则其物质的量是m/(A+16)mol,每个RO的中子数为A – N + 8个,所以每摩尔RO含中子数(A – N + 8)mol,因而物质的量为m/(A+16)mol的中子物质的量m/(A+16 )*(A – N + 8)mol,A项正确。
本题难度:一般
2、选择题 我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的 ,每百吨
,每百吨 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
[? ]
A. 原子核内含有4个质子
原子核内含有4个质子
B. 和
和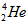 互为同位素
互为同位素
C.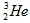 原子核内含有3个中子
原子核内含有3个中子
D.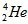 的最外层电子数为2,有较强的金属性
的最外层电子数为2,有较强的金属性
参考答案:B
本题解析:
本题难度:简单
3、选择题 硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为
[? ]
A.单质硒在通常状况下是气体
B.SeO3的水化物呈碱性
C.H2Se比H2S稳定
D.硒元素有+4.+6.-2三种常见价态
参考答案:D
本题解析:
本题难度:简单
4、选择题 短周期元素x、y、z在周期表中的位置如图所示,下列说法正确的是
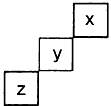
[? ]
A.x的非金属性最强
B.x单质的熔点比z低
C.z的氢化物的稳定性比y强
D.y的最高正化合价为+7
参考答案:B
本题解析:
本题难度:一般
5、推断题 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式)_____________ 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程__________________ 。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式_______________ 。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式______________ 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为____________ ;若B为常见家用消毒剂的主要成分,则B的化学式是______________ 。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是____________ ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式_______________ 。
参考答案:(1)HClO4
(2)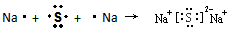 (补电子得失箭头)
(补电子得失箭头)
(3)H2(g)+1/2 O2(g) == H2O (l) ;△H=-2a kJ·mol-1
(4)H2O2 + H2S == S↓+ 2H2O
(5)离子键、(极性)共价键;NaClO
(6)HSO3- + H+ == H2O + SO2↑; Ba2+ + 2OH- +2H+ + SO42- == BaSO4↓+ 2H2O;
本题解析:
本题难度:一般