1、实验题 本题中所有的气体体积均为标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中A、B同周期且原子半径A>B。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验:
a.向第一份试样中加入过量的盐酸,充分反应后,放出0.896 L气体,还剩下0.56 g的残渣;
b.向第二份试样中加入过量的10%的NaOH溶液,充分反应后,放出0.896 L气体,还剩下0.96 g的残渣;
c.将第三份试样隔绝空气加强热后,生成一种固体,冷却后,再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质B是__________________。
(2)混合物中A的质量分数是__________________。
(3)写出实验c中有关反应的化学方程式并计算x的值。
参考答案:(1)Si? (2)63.2%
(3)2Mg+Si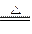 Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑,x=0.448
Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑,x=0.448
本题解析:根据实验a可知,混合物中有一种单质可溶于盐酸且产生气体,即为金属单质,另一种单质不能溶于盐酸;根据实验b,中学阶段所学固体单质能与NaOH溶液反应产生气体的只有Si、Al,但实验a中还有残渣,故不可能为Al,这种单质只可能为Si,且为0.56 g,则另一单质的质量为0.96 g。根据实验a、b所得的数据,可求0.96 g单质的摩尔质量为: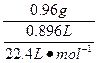 ="24" g·mol-1,即为Mg。根据原子半径A>B,可知A为Mg,B为Si。也可进行定性判断:因为A、B同周期,但金属单质不可能是Na,也不可能是Al,只能是Mg。
="24" g·mol-1,即为Mg。根据原子半径A>B,可知A为Mg,B为Si。也可进行定性判断:因为A、B同周期,但金属单质不可能是Na,也不可能是Al,只能是Mg。
(2)w(A)=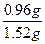 ×100%=63.2%
×100%=63.2%
(3)根据题意,2Mg+Si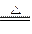 Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑。并且0.96 g Mg与0.56 g Si刚好完全反应,则
Mg2Si,Mg2Si+4HCl====2MgCl2+SiH4↑。并且0.96 g Mg与0.56 g Si刚好完全反应,则
Si? —? SiH4↑
28 g?22.4 L
0.56 g?x L
x=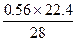 =0.448。
=0.448。
本题难度:简单
2、选择题 下列物质不属于新型无机非金属材料的是(?)
A.钢化玻璃
B.碳化硼陶瓷
C.光导纤维
D.氧化铝陶瓷
参考答案:A
本题解析:新型无机非金属材料有高温结构陶瓷和光导纤维,其中如氧化铝陶瓷、氮化硅陶瓷、氮化硼陶瓷、碳化硼陶瓷属于高温结构陶瓷。
本题难度:简单
3、计算题 钾玻璃中含有18.4%的K2O、11%的CaO、70.6%的SiO2。计算三种氧化物的物质的量之比。若需制造5.1t钾玻璃,需用碳酸钾、石灰石和二氧化硅多少吨?写出制取钾玻璃的反应方程式。
参考答案:(1)3.6 t。
(3)CaCO3+SiO2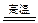 CaSiO3+CO2↑
CaSiO3+CO2↑
本题解析:
(1)K2O、CaO、SiO2的物质的量之比为
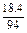 ∶
∶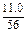 ∶
∶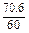 =1∶1∶6。
=1∶1∶6。
(2)设需K2CO3和CaCO3的质量分别为x和y,由关系式计算原料的用量。
K2CO3?——? K2O? CaCO3?——? CaO
138? 94? 100? 56
x? 5.1t×18.4%? y? 5.1t×11.0%
解比例式得:x=1.38t,y=1.0 t。SiO2用量为5.1t×70.6%=3.6 t。
(3)K2CO3+SiO2 K2SiO3+CO2↑; CaCO3+SiO2
K2SiO3+CO2↑; CaCO3+SiO2 CaSiO3+CO2↑
CaSiO3+CO2↑
本题难度:简单
4、填空题 硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号?,该能层具有的原子轨道数为?、电子数为?。
(2)硅主要以硅酸盐、?等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以?相结合,其晶胞中共有8个原子,其中在面心位置贡献?个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为?。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
| C-C
| C-H
| C-O
| Si-Si
| Si-H
| Si-O
|
键能(KJ/mol)
| 356
| 413
| 336
| 226
| 318
| 452
|
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是?。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是?。
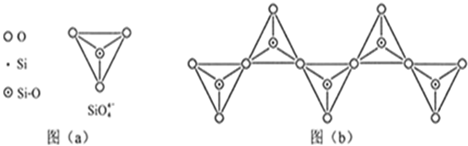
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为?。Si与O的原子数之比为?化学式为?。
参考答案:(1)M;9;4?(2)二氧化硅;?(3)共价键;3
(4)Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)①硅烷中的Si-Si键和Si-H键的键能小于烷烃分子中C-C键和C-H键的键能,稳定性差,易断裂,导致长链硅烷难以形成,所以硅烷在种类和数量上都远不如烷烃多。
②由于键能越大,物质越稳定,C-H键的键能大于C-O键的键能,故C-H键比C-O键稳定;而Si-H键的键能却远小于Si-O键的键能,所以Si-H键不稳定,而倾向于形成稳定性更强的Si-O键,即更易生成氧化物。
(6)sp3;1:3;[SiO3]n2n-(或SiO32-)
本题解析:(1)基态Si原子中,有14个电子,核外电子排布式为1s22s22p63s23p2,电子占据的最高能层符号为M。该能层具有的原子轨道数为1个s轨道,3个p轨道,5个d轨道。
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石都属于原子晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献为6×1/2=3个原子。
(4)Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si + 4NH4Cl=SiH4+4NH3+2MgCl2。
(5)①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成。②SiH4的稳定性小于CH4,更易生成氧化物,原因是C—H键的键能大于C—O键,C—H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键。
(6)中心原子Si原子的杂化形式为sp3,Si与O的原子数之比为1∶3,化学式为[SiO3]n2n-(或SiO32-)。
本题难度:一般
5、填空题 下图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。试完成下列问题:
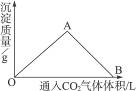
OA段曲线和AB段曲线所表示的反应方程式是
OA:_________________________________________________________________________;
AB:_________________________________________________________________________。
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为_______________。
B处溶液中存在的浓度较大的两种离子是_____________和_____________(填离子符号)。
将B处生成的溶液煮沸,可见到的现象是______________________________。
参考答案:Ca(OH)2+CO2====CaCO3↓+H2O
CaCO3+CO2+H2O====Ca(HCO3)2
1∶1? Ca2+?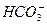 ?有白色沉淀生成
?有白色沉淀生成
本题解析:这是一道涉及碳酸正盐和碳酸氢盐互变规律的试题。如果能把握住下述规律,解题就会变得轻而易举。
(1)碳酸的正盐与过量的CO2反应时生成碳酸氢盐。
(2)碳酸氢盐与碱反应时生成碳酸的正盐和水。
(3)碳酸氢盐在加热条件下生成碳酸正盐、水和CO2。
OA段曲线表示在Ca(OH)2饱和溶液中,随着CO2通入量的增加,生成的CaCO3沉淀逐渐增多。其发生的化学反应为:
Ca(OH)2+CO2====CaCO3↓+H2O?①
AB段曲线表示CaCO3沉淀不断地与CO2发生化学反应,生成了易溶于水的碳酸氢盐。其发生的化学反应为:
CaCO3+CO2+H2O====Ca(HCO3)2?②
由①式可知,在A点的物质体系中只有CaCO3和水,参加反应的CO2和Ca(OH)2的物质的量比为1∶1。
由②式可知,在B处的物质体系中是Ca(HCO3)2溶液,其中浓度较大的两种离子是Ca2+和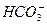 。
。
如果将B处的溶液煮沸,则会有白色沉淀生成:
Ca(HCO3)2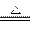 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
本题难度:简单