1、选择题 下列有关能量转换的说法不正确的是
[? ]
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是化学能转变成热能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列叙述合理的是( )
A.金属材料都是导体,非金属材料都是绝缘体
B.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
C.水电站把机械能转化成电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染“
参考答案:A.非金属材料石墨是导体,故A错误;
B.丝、毛的成分是蛋白质,蛋白质含氮元素,燃烧有氮氧化物生成,故B错误;
C.核电站把核能转化成电能,故C错误;
D.商家不得无偿提供塑料袋,可减少“白色污染“,故D正确.
故选D.
本题解析:
本题难度:简单
3、选择题 已知:①能量越低的物质越稳定,②白磷转化成红磷放出热量。
据此,下列判 断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相同
D.红磷容易发生自燃而白磷则不会自燃
参考答案:A
本题解析:白磷转化成红磷放出热量则白磷的能量比红磷的能量高,而能量越低的物质越稳定,所以红磷更稳定。A正确。C选项中红磷和白磷是同素异形体,结构不相同,组成的元素相同。D选项,白磷在加热至300℃时会发生破裂,成为红磷,白磷在空气中44℃即发生自燃,而红磷的着火点为240℃,因此白磷更容易自燃。
点评:本题联系反应热先判断白磷与红磷的能量谁高,再判断谁更稳定。C和D选项则涉及到了结构和化学性质,需要学生记忆基本的化学知识。
本题难度:简单
4、选择题 下列反应中生成物总能量高于反应物总能量的是
A.盐酸和氢氧化钠溶液间的中和反应
B.乙醇的燃烧
C.碳酸钙受热分解
D.铝粉与盐酸反应
参考答案:C
本题解析:略
本题难度:简单
5、填空题 (14分)图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据题意回答下列问题

(1)写出NO2和CO反应的热化学方程式?。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=?。
(3)此温度下该反应的平衡常数K=?;温度降低,K?(填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容?器
| 甲
| 乙
| 丙
|
反应物投入量
| 1 mol NO2
1 mol CO
| 2 mol NO
2 mol CO2
| 1 mol NO2、1 mol CO
1 mol NO、1 mol CO2
|
平衡时c(NO) /mol·L-1
| 1.5
| 3
| m
|
能量变化
| 放出a kJ
| 吸收b kJ
| 放出c kJ
|
CO或NO的转化率
| α1
| α2
| α3
|
?
则:α1+ α2=?, a+b/2=??,m=?
参考答案:

(3) 9 ;?变大
(4) 1 ;? 234 ;? 3
本题解析:(1)根据能量变化图,反应热等于生成物的总能量减去反应物的总能量,反应物和生成物能量的差值为E2-E1,写出化学方程式,标出各物质的状态,从而写出热化学方程式;(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据v=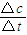 计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大;(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1;?令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ乙中吸收的热量为2n×234kJ=bkJ,整理得a+
计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大;(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1;?令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ乙中吸收的热量为2n×234kJ=bkJ,整理得a+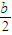 =234;丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
=234;丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
本题难度:困难