1、选择题 下列说法正确的是?(?)
A.若氢气和氧气化合是放热反应,则水电解生成氢气和氧气是吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应放出热量的多少与反应物的质量和状态无关
D.对放热反应A+B→C+D ,A、B的能量总和大于C、D的能量总和
参考答案:AD
本题解析:略
本题难度:简单
2、选择题 已知石墨在一定条件下转化成金刚石是吸热反应,由此可能出的正确结论是
A.石墨比金刚石更稳定
B.金刚石比石墨更稳定
C.石墨转化成金刚石是物理变化
D.石墨和金刚石的结构相同
参考答案:A
本题解析:根据题意可知,石墨的能量小于金刚石的,能量越低越稳定,所以石墨稳定。金刚石和石墨都是碳的同素异形体,二者的结构不同,它们之间相互转化是化学变化,答案选A。
本题难度:一般
3、选择题 下列说法中正确的是( )
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.化学反应速率为0.8mol/(L?s)是指1s内生成0.8mol该物质
C.化学键只能使原子相结合,不能使离子相结合
D.天然气﹑石油和水煤气分别属于化石能源﹑可再生能源和二次能源
参考答案:A、化学反应的本质是化学键的断裂与形成,化学反应中能量变化的微观表现是断开化学键吸收的能量与形成化学键放出的能量不相等,故A正确;
B、化学反应速率为0.8mol/(L?s)是指单位时间内,在单位体积的容器中发生化学反应的同时会生成0.8mol该物质,故B错误;
C、化学键既能是原子间的强相互作用,也能是离子间的强相互作用,故C错误;
D、天然气属于“化石能源”,水煤气均属于“二级能源”,煤和石油都是“不可再生能源”,故D错误.
故选A.
本题解析:
本题难度:简单
4、选择题 用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 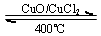 ?2Cl2+2H2O
?2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量。
Ⅱ、
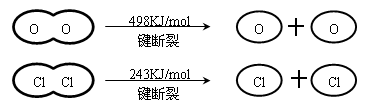
判断下列说法正确的是
A.反应A的△H >-115.6 kJ·mol-1
B.H2O中H—O 键比HCl中H—Cl键弱
C.由Ⅱ中的数据判断氯元素的非金属性比氧元素强
D.断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为32kJ
参考答案:D
本题解析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有4x+498kJ-2×243kJ-2×2×y=-115.6kJ,解得y-x=31.9,所以选项D正确,A和B不正确。键能大小不能作为判断氯元素和氧元素非金属性强弱的依据,C不正确,答案选D。
点评:该题是中等难度的试题,试题设计新颖,基础性强。该题的关键是明确从微观的角度去理解反应热的计算,有利于培养学生严谨的逻辑思维能力和发散思维能力,以及灵活运用基础知识解决实际问题的能力。
本题难度:简单
5、选择题 下列说法正确的是( )
A.已知:H2(g)+ O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
B.已知:S(g)+O2(g)===SO2(g) ΔH1=-Q1 ;S(s)+O2(g)===SO2(g) ΔH2=-Q2,则Q1<Q2
C.已知: H2SO4(浓)+NaOH(aq)="=="
H2SO4(浓)+NaOH(aq)="=="  Na2SO4(aq)+H2O(l) ΔH1;
Na2SO4(aq)+H2O(l) ΔH1;
CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l) ΔH2,则有|ΔH1|<|ΔH2|
D.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1
 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1