1、填空题 (14分)下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
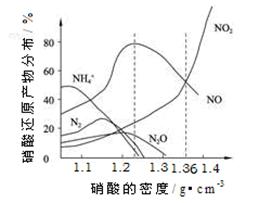
⑴下列叙述中正确的是(填序号)?。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越大。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越多。
D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2
⑵ 当硝酸溶液的密度为1.36 g·cm-3时,下列化学方程式中,能较准确表达Fe与过量硝酸反应的是(填序号)?。
A.2Fe + 10HNO3 ="=" 2Fe(NO3?)3 + NO↑+3NO2↑+5H2O
B.4Fe + 18HNO3 ="=" 4Fe(NO3?)3 + 3NO↑+3NO2↑+9H2O
C.3Fe + 12HNO3 ="=" 2Fe(NO3?)3 + Fe(NO3?)2 + 2NO↑+2NO2↑+3H2O
⑶ 密度为1.26 g·cm-3,质量分数为50.0 %的硝酸,其物质的量浓度是?mol·L-1。
⑷ 限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。
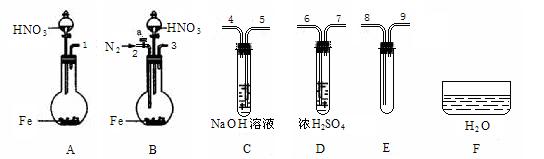
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择? (填装置序号),理由是?。
②装置的连接顺序是(填各装置接口的序号):[? ]→[? ] [? ]→[8] [9]→[? ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④ 取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是?。
参考答案:

本题解析:略
本题难度:一般
2、选择题 下列关于硒的叙述中,不正确的是(?)

A.硒在空气中燃烧生成SeO2,和钠反应生成Na2Se

B.硒化氢有恶臭味,有毒,比硫化氢易分解

C.硒化氢在空气中不能燃烧

D.亚硒酸(H2SeO3)是一种弱酸
参考答案:C
本题解析: 硒和硫同属氧族元素,但硒的核电荷数,原子半径都比硫大,这两种元素除化学性质相似外,硒的非金属性比硫弱,据此可作硫在空气中燃烧生成二氧化硫;与钠能组成化合物Na2S;硫化氢有臭鸡蛋气味,有剧毒;硫化氢在空气充足时燃烧生成二氧化硫和水,在空气不足时燃烧生成硫单质和水;亚硫酸为中强酸
硒和硫同属氧族元素,但硒的核电荷数,原子半径都比硫大,这两种元素除化学性质相似外,硒的非金属性比硫弱,据此可作硫在空气中燃烧生成二氧化硫;与钠能组成化合物Na2S;硫化氢有臭鸡蛋气味,有剧毒;硫化氢在空气充足时燃烧生成二氧化硫和水,在空气不足时燃烧生成硫单质和水;亚硫酸为中强酸 而硒的非金属性比硫弱,所以硒化氢比硫化氢易分解,亚硒酸的酸性比亚硫酸弱,应是弱酸
而硒的非金属性比硫弱,所以硒化氢比硫化氢易分解,亚硒酸的酸性比亚硫酸弱,应是弱酸
本题难度:一般
3、实验题 (10分)某同学用下面装置实现铜与浓、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按下图所示连接仪器、检查气密性、装入化学试剂。
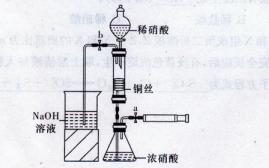
(1)过程I发生反应的离子方程式是______________________。
(2)过程Ⅱ将铜丝做成螺旋状的目的是______________________。
(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触.操作是______________________。当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。
②换入另一注射器后,打开b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体产生。稀硝酸充满玻璃管的实验目的是______________________。
(4)已知:NO+NO2+2NaOH?2NaNO2+H2O;2NO2+2NaOH?NaNO3+NaNO2+H2O,NO和NO2的混合气体的组成可表示为NOx。将该混合气体通人NaOH溶液被完全吸收时,x的取值范围应为______________。
参考答案:(10分,每空2分)
(1)Cu2(OH)2CO3+4H+?2Cu2++CO2↑+3H2O。
(2)增大铜丝与酸的接触面积,提高化学反应速率。
(3) ① 打开止水夹a和b,从注射器中推入空气; ② 将玻璃管中的NO2排出。
(4)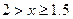 。
。
本题解析:略
本题难度:一般
4、实验题 (16分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。
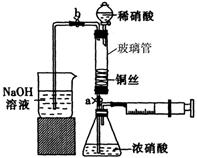
(1)过程I发生反应的离子方程式是?。
(2)写出过程III中检查气密性的方法?。
⑶过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是?,一段时间后使反应停止的操作是?,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是?,该反应的离子方程式是?。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):
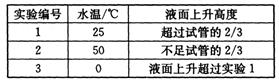
①根据上表得出的结论是温度越?(填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2?3HNO2 =HNO3+2NO?+H2O;
b.HNO2不稳定。
则产生上述现象的原因是?。
参考答案:(1)Cu2(OH)2CO3+4H+==2Cu2++CO2↑+3H2O(2)打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好。(类似方法都正确)(3)①产生红棕色气体?轻轻将注射器活塞向右拉使铜丝和溶液分开②将玻璃管中的NO2和空气排出? 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(4)①低;②温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
本题解析:(1)稀硫酸溶解铜绿离子方程式为Cu2(OH)2CO3+4H+==2Cu2++CO2↑+3H2O。
(2)检查装置气密性的方法是打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好。
(3)铜与浓硝酸反应生成红棕色气体,溶液变蓝。使反应停止即让铜和硝酸不接触,可将注射器活塞向右拉使铜丝和溶液分开。进行铜与稀硝酸实验前将玻璃管内充满溶液的目的是排出玻璃管中的二氧化氮气体和空气,便于观察到一氧化氮气体的生成,铜与稀硝酸反应离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(4)由表格中数据可知温度越低,液面上升的高度越高。原因是温度低,亚硝酸分解产生气体少,进入试管的溶液多。
点评:注重对课本实验的重组、探究。
本题难度:一般
5、选择题 向某溶液中通入NO2,一段时间后,在该溶液中一定能大量共存的离子组是
A.Na+、H+、SO42-、I-
B.Na+、Ca2+、CO32-、Al3+
C.Na+、K+、Fe2+、H+
D.K+、SO42-、Cl-、H+
参考答案:D
本题解析:正确解法:NO2会与水发生氧化还原反应生成HNO3.A选项中的I-会被HNO3氧化成I2.B选项中的Ca2+与CO32-会生成难溶物,一定不能大量共存.
C选项中的Fe2+具有还原性,会被HNO3氧化.D选项中的离子在题设条件下能够大量共存.
点评:同学们在解题时如果遇到“NO3-”,就要看题目的条件中是否隐含了酸性条件,再看离子间能否发生氧化还原反应.
本题难度:困难