1、选择题 相同状况下,在体积相同的三个烧瓶中分别盛有NH3、HCl和NO2气体,并分别倒立于水槽,充分溶解后烧瓶内三种溶液物质的量浓度之比为(设烧瓶内溶质未扩散到水槽中)(?)
A.1∶1∶1
B.2∶2∶3
C.3∶3∶2
D.2∶2∶1
参考答案:A
本题解析:因为进入烧瓶的溶液的体积就是所吸收的气体的体积,都可以直接计算,虽然NO2溶解后溶液体积只能是容器体积的2/3,但是转变成HNO3的N元素也只有NO2中N元素的2/3。
本题难度:简单
2、选择题 如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

[? ]
实验现象
解释
A.
浓盐酸附近产生白烟?
NH3与浓盐酸反应产生了NH4Cl固体
B.
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C.
氯化物溶液变浑浊
?该溶液一定是AlCl3溶液
D.
干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝
NH3是一种可溶性碱
参考答案:A
本题解析:
本题难度:一般
3、选择题 常温下,向15 mol·L-1的HNO3溶液中加入下列物质,反应速率最快,现象最明显的是(?)
A.Al
B.Cu
C.Fe
D.C
参考答案:B
本题解析:15 mol·L-1的HNO3为浓HNO3,常温下,Al、Fe在浓HNO3中发生钝化,Cu比C易与浓HNO3反应,故选B项。
本题难度:简单
4、选择题 往NaBr溶液加入AgNO3溶液,出现沉淀的颜色是
A.白色
B.淡黄色
C.黄色
D.黑色
参考答案:B
本题解析:反应生成AgBr沉淀,为淡黄色。
本题难度:简单
5、实验题 某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。

(1)A中的化学反应方程式:?。
(2)A装置还可用于制取气体?(只填一种)
(3)若有21.4gNH4Cl固体,最多可制取NH3(标准状况)的体积是?L (NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是?
(5)C、D装置中颜色会发生变化的是?(填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是?
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是?(填“F”或“G”)。
(8)生石灰与水作用放出热量。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列?物质代替(填序号)。
A.碱石灰(NaOH和CaO的固体混合物)? B.NaOH 固体?
C.硫酸溶液?D.石灰石(含CaCO3))
参考答案:(共11分)(1)2NH4Cl?+?Ca(OH)2?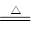 ?CaCl2?+?2NH3↑+?2H2O?(2分)
?CaCl2?+?2NH3↑+?2H2O?(2分)
(2)O2(或氧气,其他合理答案也给分(1分)
(3)8.96 (2分)? (4)向下排空气法(1分)
(5)D(1分)?(6)有白烟生成(1分)?
(7)F(1分)? (8)A B(2分)
本题解析:(1)A装置是实验室制取氨气的,所以A中的化学反应方程式2NH4Cl?+?Ca(OH)2?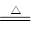 ?CaCl2?+?2NH3↑+?2H2O。
?CaCl2?+?2NH3↑+?2H2O。
(2)A装置的特点是固体和固体加热制备气体的,所以还可以制备氧气。
(3)21.4gNH4Cl固体的物质的量是21.4g÷53.5g/mol=0.4mol,则根据反应的化学方程式可知,生成氨气的体积是0.4mol×22.4L/mol=8.96L。
(4)氨气极易溶于水,且氨气的密度小于空气的,所以实验室收集氨气的方法是向下排空气法。
(5)氨气不能使干燥的红色石蕊试纸变蓝,所以C、D装置中颜色会发生变化的是D。
(6)浓盐酸和氨气反应生成氯化铵固体小颗粒,所以可观察到的现象是有白烟生成。
(7)氨气极易溶于水,进行尾气处理时,要防止倒吸,所以正确的答案选F。
(8)碱石灰或氢氧化钠固体,均易吸水,且增大溶液中OH-离子的浓度,可用于代替生石灰,答案选AB。
点评:该题是基础性试题的考查,试题难易适中,注重基础,兼顾能力的训练和培养,难度不大,学生不难得分。有利于培养学生分析问题、解决问题的能力,也有利于提高学生的规范答题能力和应试能力。
本题难度:一般