1、选择题 下列叙述正确的是(? )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:C
本题解析:略
本题难度:简单
2、选择题 质量相等的下列烃完全燃烧时,消耗氧气的量最多的是( )
A.丙烷
B.丙烯
C.丁炔
D.甲苯
参考答案:A
本题解析:
本题难度:简单
3、填空题 金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体成,则生成该气体的电极反应式为 。
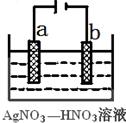
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
参考答案:(1)b、d(2分,漏选得1分,错选或多选得0分)
(2)Cu2S(2分);4(2分);氢气(2分)
(3)a(2分);NO3-+e-+2H+=NO2↑+H2O(2分)
(4)做电解质溶液(或导电)(2分)
本题解析:(1)NaCl与Al2O3冶炼需要用电解法,Fe2O3与Cu2S可以用热还原法,选b、d
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素化合价由-2升高到+6,Cu2S做还原剂;当有1molO2参与反应转移的电子为4mol,由于Cu2+水解呈酸性,加入镁条时,镁与H+反应生成了氢气。
(3)电解精炼时,不纯金属做阳极,这里就是a极;b电极是阴极,发生还原反应,生成了红棕色气体是NO,遇空气氧化生成的NO2,电极反应:NO3-+3e-+4H+=NO↑+2H2O。或NO3-+e-+2H+=NO2↑+H2O
(4)做电解质溶液,形成原电池。
考点:考查氧化还原反应、电化学等基础知识。
本题难度:困难
4、选择题 下列说法一定正确的是(NA表示阿伏加德罗常数)?
A.常温下4.4gN2O与标准状况下2.24LCH4均含有0.1NA个分子
B.78g金属钾(K)完全转化为超氧化钾(KO2)时,转移电子数为4NA
C.0.1mol/L稀盐酸中,H+数目为0.1NA
D.60g二氧化硅晶体中,含S—O键数目为2NA
参考答案:A
本题解析:A项中4.4gN2O为0.1mol,标准状况下2.24LCH4也为0.1mol,A项正确;B项中钾在超氧化钾中显+1价,转移电子数为2NA,B项错误;C项中未指明溶液的体积,错误;D项中Si-O键数目为4NA,D项错误。
本题难度:一般
5、选择题 现将金属镁和铝的混合物7.5g完全溶解于一定浓度足量的硝酸溶液中,收集反应产生的A 气体。向所得溶液中加入过量烧碱溶液,得到沉淀11.6 g。则气体A的成分可能是
A.0.2mol NO和0.1mol NO2
B.0.3 mol NO
C.0.1mol NO、0.2mol NO2和0.1mol N2O4
D.0.3 mol NO2和0.1mol N2O4