1、选择题 在下图中的8个装置中,属于原电池的是( )
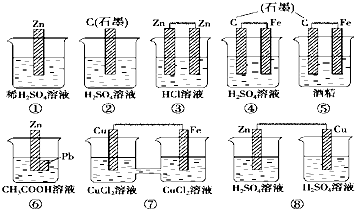
A.①④⑤
B.③⑥⑧
C.④⑥⑦
D.⑥⑦⑧
参考答案:①该装置只有一个电极材料,所以不能形成原电池,故错误.
②该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
③两电极材料相同,所以不能形成原电池,故错误.
④该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑤酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
⑥该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑦该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑧该装置两电极间不能构成闭合回路,所以不能形成原电池,故错误.
故选C.
本题解析:
本题难度:简单
2、选择题 下列说法中,正确的是(?)
A.原电池是将电能转化为化学能的装置
B.在原电池中,负极上发生氧化反应
C.在原电池中,电子从原电池的正极流向负极
D.由于生铁中含有碳,所以生铁比纯铁耐腐蚀
参考答案:B
本题解析:A不正确,原电池是将化学能转化为电能的装置。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以B正确,C不正确。生铁中含有碳,易形成原电池加快腐蚀,D不正确,答案选B。
本题难度:一般
3、选择题 有关下图装置的说法中正确的是
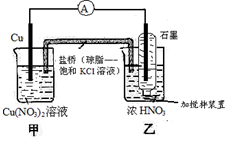
A.氧化剂与还原剂必须直接接触,才能发生反应
B.乙池中电极反应式为NO3-+4H+ + e-=NO2↑+2H2O
C.当铜棒质量减少6.4g时,甲池溶液质量增加6.4g
D.当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12LO2,将使气体全部溶于水
参考答案:D
本题解析:A、该原电池中氧化反应与还原反应是在2个不同的烧杯中完成的,因此氧化剂与还原剂没有直接接触,A不正确;乙池是正极溶液中的NO3-得到电子,电极反应式为NO3-+2H+ + e-=NO2↑+H2O,B不正确;C、当铜棒质量减少6.4g即0.1mol时,甲池溶液铜离子增加0.1mol,但由于盐桥中氯离子向甲池中移动,所以溶液增加的质量大于6.4g,C不正确;D、当铜棒质量减少6.4g即0.1mol时,转移电子的物质的量是0.2mol,所以根据电极反应式NO3-+2H+ + e-=NO2↑+H2O可知生成NO2的物质的量是0.2mol,则根据反应式4NO2+O2+2H2O=4HNO3可知需要氧气的物质的量是0.05mol,标准状况下的体积是1.12L,D正确,答案选D。
本题难度:一般
4、选择题 下列表述中,合理的是
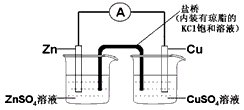
[? ]
A. 把SO2通入品红试液,可验证SO2水溶液的酸性
B. 构成如图所示装置时,盐桥中的K+移向ZnSO4溶液
C. 配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏低
D. 已知:4NH3(g) + 3O2(g) === 2N2(g) + 6H2O (l) ΔH1,N2(g) + O2(g) === 2NO(g) ΔH2,则4NH3(g)+
5O2(g)===4NO(g)+6H2O(l) ΔH3=ΔH1+2ΔH2
参考答案:D
本题解析:
本题难度:一般
5、填空题 已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4?
?2H2O+2PbSO4;
镍镉碱性充电电池在放电时,其:
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用.镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用.回答下列问题:
(1)铅蓄电池在放电时的负极反应为______,其在充电时阳极反应为______;
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为______;
(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是______;
(4)如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4______mol.
参考答案:(1)铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4放电
本题解析:
本题难度:一般