1、填空题 (15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
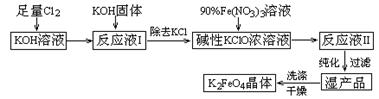
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
参考答案:(1)温度较低(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
(3)+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。
(4)FeO42-+3e-+4H2O= Fe(OH)3+5OH-;2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物
(6)KNO3 KCl
本题解析: (1)根据反应方程式可知:该生产工艺应在温度较低的情况下进行;(2)在工业上一般用电解法制取氯气。制取Cl2的化学方程式为2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3和KCl。
2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3和KCl。
考点:考查反应条件的选择、物质的制取方法、方程式与电极式的书写等知识。
本题难度:困难
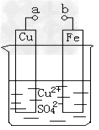
2、选择题 某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
[? ]
A.a和b用导线连接时,正极发生的反应:Cu2+?+2e-?==Cu
B.a和b不连接时,铁片质量会增加,原因是发生:Cu2+?+?Fe?=?Cu?+?Fe2+?
C.无论a和b是否连接,铁片均被腐蚀,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接电源正、负极,Cu电极发生的反应:4OH--4e-?==?2H2O?+?O2↑?
参考答案:D
本题解析:
本题难度:一般
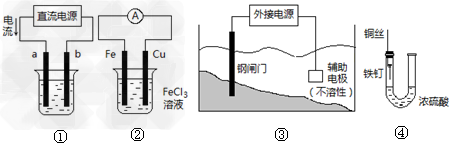
3、选择题 关于下列各装置图的叙述中,不正确的是?
[? ]
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
参考答案:B
本题解析:
本题难度:一般
4、计算题 (6分)(1) 将铁片和铜片用导线连接并插入足量的CuSO4溶液中,当导线上有0.2mol电子通过时,从理论上分析铁片和铜片的质量变化(写出计算过程);
(2) 将(1)的反应中的铜片和导线去掉,也能发生反应,同样发生0.2mol电子转移时,铁片上的质量又如何变化?(简要地写出计算过程)
参考答案:(1)铁片质量减少5.6g,铜片质量增加6.4g
(2)铁片增重0.8g
本题解析:考查原电池的有关计算。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以铁是负极,铜是正极,溶液中的铜离子得到电子而形成铜。如果不用导线相连,则铁直接和硫酸铜发生置换反应。
(1)铁比铜活泼,铁是负极,铜是正极,电极反应式分别是
Fe?-? 2e-?=? Fe2+?、?Cu2+?+? 2e-?=? Cu
56g? 2mol? 2mol? 64g
5.6g? 0.2mol?0.2mol? 6.4g
即铁片质量减少5.6g,铜片质量增加6.4g
(2)去掉导线,则发生反应
Fe+CuSO4=FeSO4+Cu?~e-?~△m↑
56g? 64? 2mol? 8g
0.2mol? 0.8g
即铁片增重0.8g。
本题难度:一般
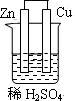
5、选择题 下列为原电池装置的是
 ?
?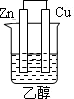 ?
?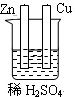 ?
?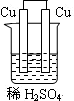
A? B? C? D
参考答案:A
本题解析:考查原电池的构成,构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中,所以A正确。B中乙醇是非电解质,C中没有用导线相连,D中电极是同一种金属,且和稀硫酸不反应,答案选A。
本题难度:一般