1、填空题 N2O5—是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是?。
(2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将? (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s
| 0
| 500
| 1000
|
e(N2O5)/mol·L-1
| 5.00
| 3.52
| 2.48
|
则500 s内N2O5的分解速率为?。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2?T1。
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的?区生成,其电极反应式为?。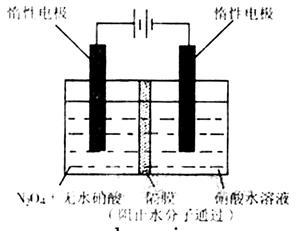
2、填空题 (1)对于下列反应:2SO2 + O2  2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
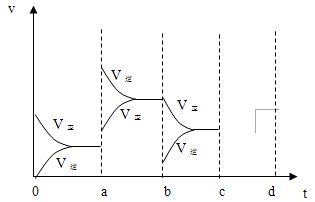
(2)下图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增 大压强时,反应速度变化情况画在c~d处.
大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸:
3、选择题 将4 mol A和2 mol B放入2L密闭容器中发生反应2A(g)+B(g) 2C(g) △H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) △H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
[? ]
A.4 s内,v(B)=0.0075 mol/(L·s)
B.当c(A):c(B):c(C)=2:1:2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度减小
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
4、填空题 把大气中的游离态的氮转化为氮的化合物的过程称为固氮。生物固氮和大气固氮(闪电时N2转化为NO)属于自然固氮,这远不能满足人类的需要。工业固氮(合成氨)是目前人工固氮的主要方法。有关大气固氮和工业固氮的平衡常数K值分别如下表一和表二。
表一:N2+ O2?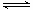 ?2NO?
?2NO?
温度
| 27℃
| 2000℃
|
K值
| 3.84×10-31
| 0.1
|
?
表二:N2+ 3H2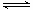 2NH3?
2NH3?
温度
| 25℃
| 350℃
| 400℃
| 450℃
|
K值
| 5×108
| 1.847
| 0.507
| 0.152
|
(1)根据上表中的数据分析,下列说法正确的是_________。
A、N2+ O2?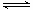 ?2NO是吸热反应
?2NO是吸热反应
B、人类大规模模拟大气固氮是没有意义的
C、在常温下,增加工业固氮的容器的压强,K值会发生改变
D、工业固氮是放热反应
(2)向某密闭容器中加入4 mol NH3、1.2 mol H2和一定量的N2三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知0~t1阶段保持恒温、恒容,且c(N2)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件。
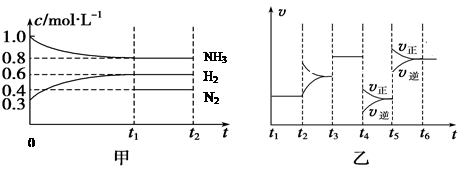
①若t1="15" s,则t0~t1阶段的反应速率为v(H2)=
②N2的起始物质的量为
③反应达到平衡状态,下列说法中能表明已达到平衡状态的是?
A、单位时间内生成a molN2,同时生成3a mol H2?B、容器的总压强不再变化
C、混合气体的密度不再变化? D、三个H—H 键断裂的同时有六个H—N键断裂
④t4时刻改变的条件为 ? ,t5时刻改变的条件为 ?
⑤已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式:____________________________________________________________________
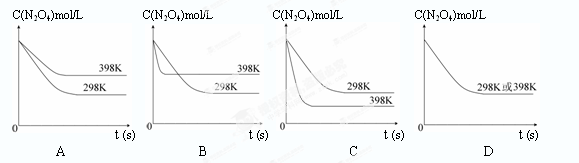
5、填空题 在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
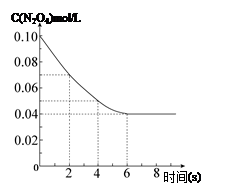
(1)计算在2s至4s时间内,NO2的平均生成速率为?。(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,二氧化氮的起始浓度是?mol·L-1。
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于?。化学平衡常数为?。
(4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向?方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是? (? )
A.α2<α1? B.α2>α1? C.α2=α1? D.无法判断。
(5)下表是不同温度下测定的该反应的化学平衡常数。
?
据此判断该反应正反应是?反应(填“吸热”或“放热”)
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是? (? )