1、填空题 (8分)由以下一些微粒: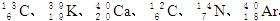 。其中:
。其中:
(1)互为同位素的是________和________;
(2)质量数相等,但不能互称同位素的是________和__________;
(3)中子数相等,但质子数不相等的是______和____ _、______和___? _。
2、选择题 下列关于物质性质的比较,不正确的是

A.金属性强弱:Na >Mg> Al
B.原子半径大小:Na> S >O
C.碱性强弱:KOH > NaOH > LiOH
D.酸性强弱:HIO4 >HBrO4> HClO4
3、填空题 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
?
(1)画出G的原子结构示意图___________________
(2)A、B、C、E、F五种元素的原子半径最大的是___________(填化学式)
(3)E、F、G元素的最高价氧化物对应水化物的酸性较弱的是_____________(用化学式表示)
(4)写出C和F形成化合物的电子式______________________
4、推断题 结构决定性质,性质决定用途;已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,Z的单质在常温下均为无色气体,W原子的最外层电子排布是nSn npn+2,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出W元素的元素符号和该原子基态的电子排布式:__? _____
(2)写出Z元素的原子结构示意图和该原子基态的电子排布图:?_? _____?
(3)X单质和Z单质在一定条件下反应生成化合物E,则E的电子式是:?。E可以进行喷泉实验的主要原因是:?。
(4)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为___________? __________________???
(5)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序)为(写名称)?,该化合物的浓溶液与足量NaOH热浓溶液反应的离子方程式为:____________? __? __
5、填空题 (8分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置?;
(2)E元素形成的最高价氧化物对应的水化物的化学式为?;
(3)元素C、D、E形成的离子半径大小关系是?>?>?(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程?。
C、D还可形成化合物D2C2,D2C2含有的化学键是?。
(5)由A、B、C三种元素形成的离子化合物的化学式为?。