1、填空题 (8分)由以下一些微粒: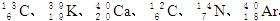 。其中:
。其中:
(1)互为同位素的是________和________;
(2)质量数相等,但不能互称同位素的是________和__________;
(3)中子数相等,但质子数不相等的是______和____ _、______和___? _。
参考答案:(1) (每空1分)
(每空1分)
本题解析:略
本题难度:一般
2、选择题 下列关于物质性质的比较,不正确的是

A.金属性强弱:Na >Mg> Al
B.原子半径大小:Na> S >O
C.碱性强弱:KOH > NaOH > LiOH
D.酸性强弱:HIO4 >HBrO4> HClO4
参考答案:D
本题解析:同周期自左向右金属性逐渐增强,A正确;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以选项B正确;同主族自上而下金属性逐渐增强,非金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐增强,酸性逐渐减弱,所以选项C正确,D不正确,答案选D。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力,难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:一般
3、填空题 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
?
(1)画出G的原子结构示意图___________________
(2)A、B、C、E、F五种元素的原子半径最大的是___________(填化学式)
(3)E、F、G元素的最高价氧化物对应水化物的酸性较弱的是_____________(用化学式表示)
(4)写出C和F形成化合物的电子式______________________
参考答案:(1)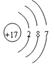 ?(2)Na?(3)H3PO4?(4)
?(2)Na?(3)H3PO4?(4)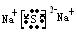
本题解析:(1)G元素为Cl,(2)A为O,B为F,C为Na,E为P,F为S,原子半径最大的为Na(3)元素非金属越强,酸性越强,故酸性最弱的是H3PO4(4)Na2S的电子式为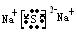 。
。
本题难度:一般
4、推断题 结构决定性质,性质决定用途;已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,Z的单质在常温下均为无色气体,W原子的最外层电子排布是nSn npn+2,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出W元素的元素符号和该原子基态的电子排布式:__? _____
(2)写出Z元素的原子结构示意图和该原子基态的电子排布图:?_? _____?
(3)X单质和Z单质在一定条件下反应生成化合物E,则E的电子式是:?。E可以进行喷泉实验的主要原因是:?。
(4)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为___________? __________________???
(5)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序)为(写名称)?,该化合物的浓溶液与足量NaOH热浓溶液反应的离子方程式为:____________? __? __
参考答案:(1)O,1s22s22p4(2)?1s22s22p3
(3)NH3 的电子式为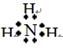 ;因为NH3极易溶于水;
;因为NH3极易溶于水;
(4)NH4++ H2O  ?NH3.H2O + H+
?NH3.H2O + H+
(5)碳酸氢铵;NH+4 ?+ HCO-3 + 2OH—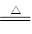 CO2-3 + NH3↑ + 2H2O(注明加热条件)
CO2-3 + NH3↑ + 2H2O(注明加热条件)
本题解析:根据题意可以推断:X为氢;Y为碳; Z为氮; W为氧;(1)中,W元素的元素符号和该原子基态的电子排布式为O,1s22s22p4;(2)中,Z元素的原子结构示意图和该原子基态的电子排布图: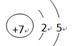 ,1s22s22p3;(3)E为NH3,NH3 的电子式为
,1s22s22p3;(3)E为NH3,NH3 的电子式为
NH3可以进行喷泉实验的主要原因是因为NH3极易溶于水;(4)由X、Z、W三种元素组成的盐为NH4NO3,长期施用会使土壤酸化是因为NH4+发生了水解,即NH4++ H2O  ?NH3.H2O + H+;(5)中,四种元素可组成原子个数比为5∶1∶1∶3的化合物为碳酸氢铵,碳酸氢铵与NaOH热浓溶液反应的离子方程式为:
?NH3.H2O + H+;(5)中,四种元素可组成原子个数比为5∶1∶1∶3的化合物为碳酸氢铵,碳酸氢铵与NaOH热浓溶液反应的离子方程式为:
NH4+?+ HCO3-+ 2OH—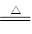 CO32-+ NH3↑ + 2H2O
CO32-+ NH3↑ + 2H2O
点评:该题综合考查了部分常见元素的相关性质以及部分有这些元素构成的化合物,有一定的综合性,但是本题总体不难。
本题难度:一般
5、填空题 (8分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置?;
(2)E元素形成的最高价氧化物对应的水化物的化学式为?;
(3)元素C、D、E形成的离子半径大小关系是?>?>?(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程?。
C、D还可形成化合物D2C2,D2C2含有的化学键是?。
(5)由A、B、C三种元素形成的离子化合物的化学式为?。
参考答案:(1)第二周期第VA族(1分,都回答正确才给分)
(2)H2SO4?(1分)?(3)S2->O2->Na+(1分)
(4)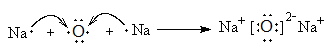 (2分) (有错不给分)
(2分) (有错不给分)
离子键、非极性共价键(或离子键、共价键)(2分,全对才给分)
(5)NH4NO3 ?(1分)
本题解析:根据元素的结构及性质可知,A、B、C、D、E分别是H、N、O、Na、S。
(1)氮元素位于第二周期第VA族。
(2)S是第ⅥA元素,最高价是+6价,所以形成的最高价氧化物对应的水化物的化学式为H2SO4。
(3)核外电子排布相同的微粒,其离子半径随原子序数的增大而减小,同主族自上而下,离子半径也是逐渐增大的,所以元素C、D、E形成的离子半径大小关系是S2->O2->Na+。
(4)氧化钠是含有离子键的离子化合物,其形成构成表示为
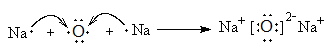 。过氧化钠是含有离子键和非极性键的离子化合物。
。过氧化钠是含有离子键和非极性键的离子化合物。
(5)H、N、O三种元素形成的离子化合物的化学式为NH4NO3。
本题难度:简单