1、选择题 NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,1mol水含有NA个H+和NA个OH-离子
B.在通常状况下,22.4?LH2和4?gHe均含有NA个分子
C.8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA
D.常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数约为0.3NA
参考答案:C
本题解析:分析:A、水是弱电解质存在电离平衡;
B、22.4?LH2在通常状况下不是1nol;
C、质量换算物质的量分别计算物质含有的铜原子比较;
D、等物质的量铁和氯气反应生成三氯化铁,结合化学方程式的过量计算判断;
解答:A、水是弱电解质不能完全电离,故A错误;
B、在通常状况下,22.4?LH2物质的量不是1mol,故B错误;
C、8.0?g?若全是Cu2S含铜原子= =0.1mol;8.0?g?若全是CuO含铜原子=
=0.1mol;8.0?g?若全是CuO含铜原子=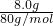 =0.1mol;所以8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA,故C正确;
=0.1mol;所以8.0?g?Cu2S和CuO的混合物中约含有铜原子数为0.1NA,故C正确;
D、0.1mol铁与0.1molCl2充分反应铁有剩余,转移电子数用全反应的氯气计算为0.2mmol,故D错误;
故选C.
点评:本题考查了弱电解质的电离平衡,气体摩尔体积的条件应用,质量换算物质的量计算微粒数,氧化还原反应的过量计算电子数的计算.
本题难度:一般
2、选择题 煤油中含有噻吩,噻吩(用X表示)有令人不愉快的气味,其燃烧的化学方程式可表示为:X+6O2 4CO2+SO2+2H2O,则噻吩X的化学式为
4CO2+SO2+2H2O,则噻吩X的化学式为
A.C4H4S2
B.C2H6S
C.C4H4S
D.C6H6S
参考答案:C
本题解析:分析:根据质量守恒定律,在化学变化前后构成物质的原子种类不变、原子个数没有变化;
利用燃烧的化学方程式可表示为:X+6O2 4CO2+SO2+2H2O,根据反应前后原子种类和个数不变,推断反应物X物质噻吩的化学式.
4CO2+SO2+2H2O,根据反应前后原子种类和个数不变,推断反应物X物质噻吩的化学式.
解答:噻吩燃烧的化学方程式可表示为:X+6O2 4CO2+SO2+2H2O,
4CO2+SO2+2H2O,
反应后的生成物质中C、O、S、H各元素的质子个数依次为:4、12、1、4;
而反应前的生成物中已知6O2中含有12个O原子;因此反应物X噻吩的分子中应含有4个C原子、4个H原子和1个S原子,则物质X的化学式为C4H4S.
故选:C.
点评:考查质量守恒,难度不大,根据反应的化学方程式,利用反应前后原子的种类和原子数目不变的原则,进行推断.
本题难度:一般
3、选择题 将标准状态下的vL某气体(相对分子质量为M)溶于水中,所得溶液的溶质质量分数为b%.将溶液蒸发掉a?g水后(该气体溶质不挥发),所得溶液的溶质质量分数为2b%,密度为ρg/mL,物质的量浓度为c?mol/L.下列关系式不正确的是
A.c=
B.c=
C.b%=
D.b%=
参考答案:D
本题解析:分析:根据n= 计算气体的物质的量,根据c=
计算气体的物质的量,根据c=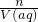 =
=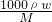 来计算,并结合质质量分数为b%变为溶液的溶质质量分数为2b%,则蒸发水的质量为溶液质量的一半,以此来计算.
来计算,并结合质质量分数为b%变为溶液的溶质质量分数为2b%,则蒸发水的质量为溶液质量的一半,以此来计算.
解答:A.气体的物质的量为 mol,蒸发后溶液的质量为ag,则c=
mol,蒸发后溶液的质量为ag,则c= =
= ,故A正确;
,故A正确;
B.根据c=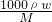 可知,稀释后c=
可知,稀释后c=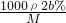 =
= ,故B正确;
,故B正确;
C.根据b%= 可知,b%=
可知,b%=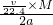 ×100%=
×100%=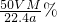 ,故C正确;
,故C正确;
D..根据c=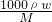 可知,b%=
可知,b%=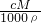 ,故D错误;
,故D错误;
故选D.
点评:本题考查物质的量浓度的有关计算,明确物质的量浓度的计算公式及物质的量浓度与质量分数的换算公式即可解答,题目难度不大.
本题难度:一般
4、选择题 下列各物质中含氢原子数最多的是
A.53.5gNH4C1
B.1.5molNH4NO3
C.1.204×1024个CO(NH2)2
D.标准状况下22.4LNH3
参考答案:C
本题解析:分析:利用选项中的各量计算出物质的量,进而计算原子数比较判断;
解答:A、53.5gNH4C1物质的量= =1mol,含氢原子为4mol;
=1mol,含氢原子为4mol;
B、1.5molNH4NO3含氢原子6mol;
C、1.204×1024个CO(NH2)2物质的量= =2mol,含氢原子物质的量8mol;
=2mol,含氢原子物质的量8mol;
D、标准状况下22.4LNH3物质的量为1mol,含氢原子物质的量为3mol;
比较上述计算可得,C项含氢原子数最多;
故选C.
点评:本题考查了 物质的量与质量、微粒数目、气体摩尔体积的计算关系应用.
本题难度:简单
5、选择题 下列变化属于化学变化的是
A.分离液态空气制氧气
B.海水晒盐
C.用汽油作溶剂清洗掉衣服上的油污
D.通过绿色植物光合作用
参考答案:D
本题解析:试题分析:本题主要对“化学变化”的考查。有新物质生成的变化为化学变化。
选项A、氧气是空气的一种成分气体,分离液态空气制氧气,并没有新物质生成,属于物理变化;
选项B、海水晒盐,是水分的蒸发,没有新物质生成,属于物理变化;
选项C、用汽油清洗油污,其原理是油污溶解于汽油中,并未有新的物质生成,属于物理变化;
选项D、绿色植物的光合作用,指的是绿色植物吸收空气中的二氧化碳转化为氧气,此时有新的物质生成,因此,属于化学变化;
考点:物理变化与化学变化的区分
点评:区别物理变化与化学变化的常用方法:
判断“物理变化”或“化学变化”的根本在于“有没有新物质的生成”。2、
从性质上区分,描述中体现出物理性质的,则属于物理变化;描述中体现化学性质的,则为化学变化。
3、可以从概念上进行区分。物理变化是指没有生成其他物质的变化,如水的蒸发;蜡烛的熔化;化学变化是指生成其他物质的变化,如铁生锈;食物的腐败。
本题难度:困难