1、简答题 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H+、Cl-)制备,其制备过程如下:
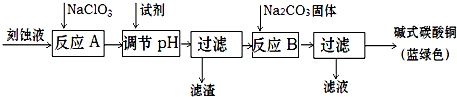
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3
开始沉淀pH
4.2
5.8
1.2
完全沉淀pH
6.7
8.3
3.2
|
(1)滤渣的主要成分是______(写化学式).
(2)调节反应A后溶液的pH范围应为______.选择的试剂最合适的是______(填序号).
a.氨水b.稀硫酸c.氢氧化钠d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是______.
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.用相应的离子方程式表示:
①沉淀只有CuCO3:______;
②沉淀只有Cu(OH)2且放出气泡:______.
(5)碱式碳酸铜的组成可表示为:aCuCO3?bCu(OH)2?cH2O.要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量.而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为______(填序号,写一组即可).
2、选择题 稀硫酸中加入铜片,无现象,再加入下列某物质后,铜片逐渐溶解,该物质为( )
A.KNO3
B.NaCl
C.FeCl3
D.Cu(OH)2
3、选择题 分别将下列物质:①明矾?②Na2O2?③NaCl?④Ca(HCO3)2?⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是
[? ]
A.①②③
B.①③
C.③④
D.③
4、简答题 某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:

已知:①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L.回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+═Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:______.
(2)萃取剂A是一类称作为肟类的有机化合物,如N-510、N-530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH?和n3个
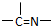
三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,分子结构中碳原子跟碳原子相连接,则A的结构简式是______.
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式:______.
(4)循环中反萃取剂B的主要成分是______.
(5)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质.取该矿石样品200.0g,用100mL1.0mol?L-1H2SO4溶液浸取后,还需加入10mL?1.0mol?L-1?Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到?6.4gCu.求铜矿石样品中氧化亚铜和氧化铁的质量分数?
5、填空题 1.分离下列几组混合物,将合适的分离方法的序号填在横线上。 A、过滤 B、蒸馏 C、结晶 D、分液
(1)分离水和四氯化碳的混合物:____________;
(2)分离沙子与饱和食盐水的混合物:________;
(3)从硝酸钾和氯化钾的混合液中获得硝酸钾:_________;
(4)分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物____________。
2.将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况,填写金属或金属离子:
(1)充分反应后,如果Fe有剩余,则容器内不可能有:_____________________;
(2)充分反应后,如果容器内有较多Cu2+和Cu,则容器内不可能有___________。