1、选择题 下列说法中符合碱金属特点的是(?)
A.碱金属的盐都有焰色反应,而其单质及其氧化物则没有
B.碱金属的单质及合金在通常情况下都是固体
C.碱金属氧化物都是碱性氧化物,都易溶于水
D.碱金属的绝大部分盐都是易溶于水的
2、填空题 Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
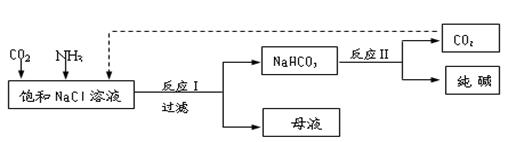
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O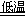 NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
?Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
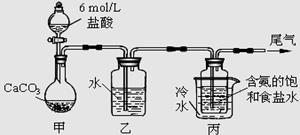
(1)装置丙中冷水的作用是?;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为?;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3?样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
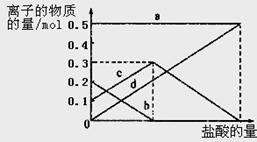
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是?; 21
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol?L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
3、选择题 Na2CO3固体中有少量的NaHCO3固体,除去NaHCO3固体选用的最好方法是
A.加入氢氧化钠
B.通入CO2气体
C.加热灼烧
D.加入盐酸
4、选择题 钾与钠相比,下列叙述不正确的是(?)
A.氧化性:K+>Na+
B.金属活动性:K>Na
C.离子半径:K+>Na+
D.原子核吸引最外层电子的能力:K>Na
5、选择题 相同温度下,在甲、乙、丙、丁四个烧杯中分别盛有等体积、等物质的量浓度的NaOH不饱和溶液,分别加入Na、Na2O、Na2O2、NaOH并恢复至原温度,使恰好都形成NaOH饱和溶液,则甲、乙、丙、丁四烧杯中加入的固体质量大小顺序是?
[? ]
A.丁>丙>乙>甲
B.丁>甲>乙>丙
C.甲=丁>乙=丙
D.丁<丙<乙<甲