1、选择题 下列说法中符合碱金属特点的是(?)
A.碱金属的盐都有焰色反应,而其单质及其氧化物则没有
B.碱金属的单质及合金在通常情况下都是固体
C.碱金属氧化物都是碱性氧化物,都易溶于水
D.碱金属的绝大部分盐都是易溶于水的
参考答案:D
本题解析:A中其单质、氧化物也有焰色反应,焰色反应仅是元素的性质,与存在方式无关;B中钠钾合金在通常状况下就是液体;C中所属氧化物如果是过氧化物或超氧化物则不是碱性氧化物。
本题难度:简单
2、填空题 Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
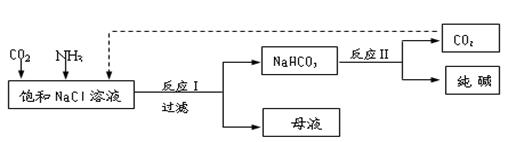
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O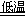 NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
?Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
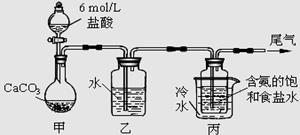
(1)装置丙中冷水的作用是?;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为?;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3?样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
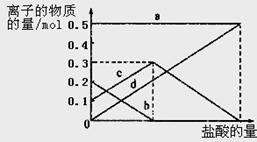
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是?; 21
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol?L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
参考答案:Ⅰ(1)NH3?
(2)HCO3–+NH3=NH4++CO32–
Ⅱ.(1)冷却,使碳酸氢钠晶体析出
(2)过滤? 2NaHCO3 Na2CO3+H2O+CO2↑?
Na2CO3+H2O+CO2↑?
(3)Na+ ?HCO3- ?1:2
(4)0.75 mol/L
本题解析:Ⅰ(1)向分离出NaHCO3晶体后的母液NH4Cl中加入过量石灰乳,发生的反应有Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物为氯化钙、氨气,其中氨气可再利用,故答案为:NH3;
(2)通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式HCO3–+NH3=NH4++CO32–。
Ⅱ.(1)装置丙中冷水的作用是降温,使碳酸氢钠晶体析出。
(2)由装置丙中产生的NaHCO3发生的反应为,NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(3)溶液中有关离子的物质的量的变化为:钠离子始终不变,碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子浓度变化;碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L;样品中NaHCO3和Na2CO3的物质的量之比是1:2; 故答案为:Na+ ,HCO3-; 1:2;
(4)若取21g?NaHCO3固体物质的量=21g/84g/mol=0.25mol,
加热了t1min后,剩余固体的质量为14.8g.依据化学方程式存在的质量变化计算:
2NaHCO3=Na2CO3+CO2↑+H2O?△m
2?1? 62
0.2mol? 0.1mol?21g-14.8g
反应后NaHCO3物质的量=0.25mol-0.2mol=0.05mol;NaHCO3+HCl=NaCl+H2O+CO2↑;消耗氯化氢物质的量0.05mol;
Na2CO3物质的量=0.1mol,Na2CO3+2HCl=2NaCl+H2O+CO2↑,消耗氯化氢物质的量0.2mol;
剩余氯化氢物质的量=0.200L×2mol/L-0.05mol-0.2mol=0.15mol,剩余溶液中c(H+)=
0.15mol/0.2L=0.75mol/L故答案为:0.75mol/L
本题难度:困难
3、选择题 Na2CO3固体中有少量的NaHCO3固体,除去NaHCO3固体选用的最好方法是
A.加入氢氧化钠
B.通入CO2气体
C.加热灼烧
D.加入盐酸
参考答案:C
本题解析:略
本题难度:简单
4、选择题 钾与钠相比,下列叙述不正确的是(?)
A.氧化性:K+>Na+
B.金属活动性:K>Na
C.离子半径:K+>Na+
D.原子核吸引最外层电子的能力:K>Na
参考答案:AD
本题解析:从Li→Cs失电子能力逐渐增强,其对应阳离子得电子能力逐渐减弱。A选项错,B选项对。
K+比Na+多1个电子层。C选项正确。
K的最外层电子比Na离核远,受核的束缚弱。D选项错误。
本题难度:简单
5、选择题 相同温度下,在甲、乙、丙、丁四个烧杯中分别盛有等体积、等物质的量浓度的NaOH不饱和溶液,分别加入Na、Na2O、Na2O2、NaOH并恢复至原温度,使恰好都形成NaOH饱和溶液,则甲、乙、丙、丁四烧杯中加入的固体质量大小顺序是?
[? ]
A.丁>丙>乙>甲
B.丁>甲>乙>丙
C.甲=丁>乙=丙
D.丁<丙<乙<甲
参考答案:A
本题解析:
本题难度:一般