| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《水的电离平衡》试题特训(2019年最新版)(二)
参考答案:C 本题解析:A、没有说明溶液的温度,所以不一定显中性,不选A;B、没有办法判断氢离子和氢氧根离子浓度的相对大小,所以不选B;C、氢离子和氢氧根离子浓度相等,说明溶液显中性,选C;D、没有说明酸或碱的强弱,所以不能判断溶液的酸碱性,不选D。 本题难度:一般 2、选择题 下列说法正确的是 |
参考答案:C
本题解析:A.强酸强碱盐不会影响水的电离程度,错误;B.根据越弱越水解,HClO酸性强于碳酸氢根离子,所以相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者,错误;C.根据NH3·H2O NH4+ +OH-,加入少量NH4Cl晶体,平衡逆向移动,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大,正确;D.只有在相同条件下,相同浓度的CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等,错误;选C。
NH4+ +OH-,加入少量NH4Cl晶体,平衡逆向移动,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大,正确;D.只有在相同条件下,相同浓度的CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等,错误;选C。
考点:考查水的电离,PH的大小比较,弱电解质的电离等知识。
本题难度:一般
3、选择题 下列物质的电离方程式,错误的是( )
A.HCl=H++Cl-
B.H2SO4=2H++SO42-
C.FeCl3=Fe3++Cl-
D.Ca(OH)2=Ca2++2OH-
参考答案:C
本题解析:
本题难度:一般
4、填空题 Ⅰ(8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
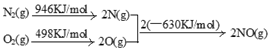
参考答案:Ⅰ(8分)(1)pH="4" 。
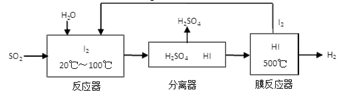
(2)N2(g)+O2(g)= 2NO(g) △H=+184kJ/mol(3)SO2+I2+2H2O=SO42-+2I-+4H+;H2-2e-+2OH-=2H2O
Ⅱ((10分)(1)取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B 中不含铁元素。(2)C(3)加入浓盐酸 过滤(4) B。
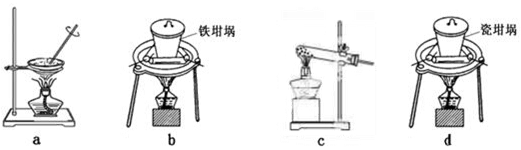
本题解析:(1)溶液呈电中性,则n(H+)+n(K+)+n(Na+)+n(NH4+)=2n(SO42-)+n(NO3-)+n(Cl-)。所以c(H+)+ 4×10-6+6×10-6+2×10-5=2×4×10-5+3×10-5+2×10-5。解得c(H+)=1×10-4,所以pH=4;(2)根据题意N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)= 2NO(g) △H="(946KJ/mol" +498KJ/mol— 2×630 KJ/mol)=+184kJ/mol;(3)①在反应器中SO2、I2、H2O发生反应产生硫酸和氢碘酸。用离子方程式表示为SO2+I2+2H2O=SO42-+2I-+4H+;②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,通入氢气的电极是负极,负极的电极反应式是H2-2e-+2OH-=2H2O;Ⅱ(1)检验滤液B中是否还含有铁元素的方法为取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B 中不含铁元素。(2)由于在滤液B中的铝元素以Al3+形式存在,若使Al3+以沉淀形式析出,由于Al(OH)3是两性物质,既可以与强酸反应液可以与强碱发生反应,所以应该用弱碱,可选用的最好试剂为氨水,选项是C;(3)由滤液B制备氯化铝晶体涉及的操作为:加入浓盐酸蒸发浓缩、冷却结晶、过滤、洗涤,就得到了氯化铝晶体。(4)SiO2和NaOH焙烧制备硅酸钠,由于NaOH是强碱,能够与玻璃、陶瓷中的SiO2发生反应,所以应该用铁坩埚,可采用的装置为B。
考点:考查溶液的酸碱性、热化学方程式的书写、铁元素的检验、试剂的使用、仪器的选择的知识。
本题难度:困难
5、选择题 下列说法正确的是( )
A.水的离子积常数KW随温度改变而改变,随外加酸碱浓度改变而改变
B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大
C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
参考答案:D
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质组成与性质实.. | |