|
|
|
高中化学知识点讲解《水的电离平衡》试题特训(2019年最新版)(一)
2019-07-04 00:21:30
【 大 中 小】
|
1、选择题 下列溶液一定呈中性的是
A.pH = 7的溶液
B.Kw = c(H+)·c(OH-) = 1.0×10-14的溶液
C.c(H+) = c(OH-)
D.pH = 3的酸与pH = 11的碱等体积混合后的溶液
|
2、选择题 下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者大于后者
C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D.室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
|
3、选择题 下列物质的电离方程式,错误的是( )
A.HCl=H++Cl-
B.H2SO4=2H++SO42-
C.FeCl3=Fe3++Cl-
D.Ca(OH)2=Ca2++2OH-
4、填空题 Ⅰ(8分)PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol?L-1
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据判断PM2.5试样的pH
。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
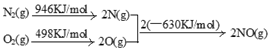
则N2和O2反应生成NO的热化学反应方程式为
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
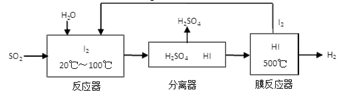
①用离子方程式表示反应器中发生的反应:
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式
_ _Ⅱ(10分)铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
(1)检验滤液B中是否还含有铁元素的方法为:
(注明试剂、现象)。
(2)将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为
(填代号)。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
(3)由滤液B制备氯化铝晶体涉及的操作为:
蒸发浓缩、冷却结晶、
、洗涤。
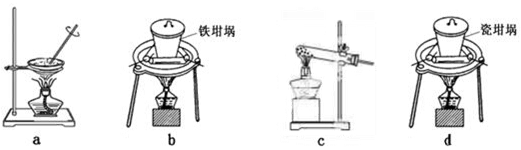
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为
(填代号)。
5、选择题 下列说法正确的是( )
A.水的离子积常数KW随温度改变而改变,随外加酸碱浓度改变而改变
B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大
C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关