| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《物质的量》高频试题预测(2019年最新版)(二)
参考答案:A 本题解析:4.0g氢氧化钠的物质的量是4.0g÷40g/mol=0.1mol。由于溶液的体积大于0.1L,所以根据 本题难度:一般 2、实验题 现用质量分数98%密度为1.84 g·cm-3浓H2SO4来配制450 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒?②烧瓶?③烧杯?④胶头滴管 参考答案:(10分) 本题解析:略 本题难度:一般 3、填空题 12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 gCO2。测得有机化合物A的蒸气对H2的相对密度是30,求: 参考答案:(1)C3H8O(2分) 本题解析:(1)根据阿伏加德罗定律可知,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,则该化合物的相对分子质量为30×2=60,则12g有机物的物质的量是 本题难度:一般 4、选择题 30 mL 1 mol/L NaCl溶液和40 mL 0.5 mol/L CaCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为( ) |
参考答案:C
本题解析:根据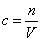 可知,混合后溶液中氯离子的浓度是
可知,混合后溶液中氯离子的浓度是 ,答案选C。
,答案选C。
考点:考查溶液中离子浓度的有关计算
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是明确溶液中氯离子的来源,然后结合公式直接列式计算即可,有助于培养学生的应试能力。
本题难度:一般
5、选择题 用NA代表阿伏加德罗常数,下列说法正确的是? (? )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.0.5molAl与足量盐酸反应转移电子数为1NA
C.500 mL 1 mol/LFe2(SO4)3溶液,同250 mL 3 mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度之比为1:1
D.46gNO2和N2O4的混合物含有的分子数为NA
参考答案:C
本题解析:A、单质可能为单原子、双原子或多原子分子,故原子数不一定相同;
B、铝反应后生成三价铝离子,故转移电子数为1.5NA;
D、全部为NO2,分子数为NA;现在一部分转化为N2O4;故分子数小于NA。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《分子式、结.. | |