1、简答题 “化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生.如图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:A、稀硫酸;B、锌粒;
C、某溶液;D、CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水
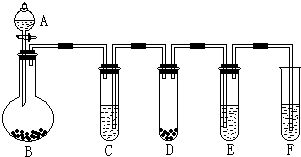
请回答下列问题:
(1)应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是______
(2)写出装置D中反应的离子方程式:______?该反应的类型是:______
装置F中反应的离子方程式:______
(3)如图所示的B~F装置中,发生了氧化还原反应的是______(填装置编号).请用单线桥表示出电子的转移______.
参考答案:(1)应开始后,若E中出现红色,说明有酸性酸性气体生成;F中有白色沉淀生成,因为D中是碳酸钙固体,F中是澄清石灰水,所以该气体只能是二氧化碳,稀盐酸和稀硝酸都可和碳酸钙反应生成二氧化碳,所以C中的物质可能是稀盐酸或稀硝酸.
故答案为:稀盐酸或稀硝酸.
(2)碳酸钙和酸反应生成钙离子、水和二氧化碳,所以离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑;该反应是酸和盐反应生成另外的酸和盐,所以是复分解反应;二氧化碳使澄清的石灰水变浑浊,二氧化碳和氢氧化钙反应生成碳酸钙和水,反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O
故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;复分解反应
CO2+Ca2++2OH-═CaCO3↓+H2O
(3)根据反应中元素的化合价是否变化判断,B、C、F中发生的化学反应分别为:Zn+H2SO4=ZnSO4+H2;CaCO3+2H+═Ca2++H2O+CO2↑;CO2+Ca2++2OH-═CaCO3↓+H2O
所以只有B属于氧化还原反应;
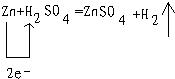
故答案为:B;
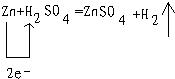
本题解析:
本题难度:一般
2、简答题 某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
实验
序号 |
混合物 | 第一步:
加入适量水,充分溶解 | 第二步:
加入或通入的试剂 | 第三步:
过滤后洗涤干燥所得固体 | 第四步:
蒸发滤液得到晶体 | 第五步:
称量,记录数据
甲
BaCl2
NaCl
澄清溶液
过量CO2
无固体
晶体
称量所得晶体
乙
CaCl2
NaCl
澄清溶液
过量饱和Na2CO3溶液
CaCO3
NaCl
称量蒸发所得晶体
丙
Na2SO4
MgSO4
澄清溶液
过量NaOH溶液
______
______
______
|
试回答下列问题:
①你认为甲同学设计的实验步骤中,根据称量所得到的数据,______?(填“能”或“不能”)准确计算得出混合物中各组分的质量比.
②经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误.其理由是______.
③丙同学对实验进行了设计,请将其后三步正确的内容仿照前面的形式填入对应的空格内.
参考答案:①二氧化碳通入溶液中和氯化钡、氯化钠不反应,蒸干溶液得到溶质固体仍为氯化钡和氯化钠固体,不能计算;
故答案为:不能;
?②混合物溶解后加入过量的碳酸钠溶液,钙离子完全沉淀,蒸发结晶得到固体为氯化钠和碳酸钠混合物,称量固体质量不能计算原混合物成分质量;
故答案为:第二步加入的碳酸钠溶液为过量的,最后所得晶体中应有碳酸钠存在;
③硫酸镁和硫酸钠混合物溶于水后加入过量氢氧化钠溶液,镁离子完全沉淀,过滤后的溶液蒸发结晶得到溶质固体为氢氧化钠和硫酸钠,称量氢氧化镁沉淀质量换算物质的量可以计算得到硫酸镁质量和硫酸钠质量;故答案为:丙Mg(OH)2NaOH?Na2SO4称量过滤后所得?Mg(OH)2固体
本题解析:
本题难度:一般
3、选择题 选用下图所示仪器组合一套町用来测定过氧化钠与水反应生成氧气体积的装置,其合理的连接顺序是

A. l -2 -3 -4 -5 -7
B. l?-2 -3 -5 -4-7
C. 6 -4 -5 -7
D. 6 -5 -4 -7
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列实验中用错试剂的是
[? ]
A.用稀盐酸清洗做焰色反应的镍铬丝
B.用酒精萃取碘水中的碘
C.用稀硝酸洗去残留在试管壁上的铜
D.用碱石灰吸收氨气中的水蒸气
参考答案:B
本题解析:
本题难度:简单
5、选择题 为了除去粗盐中的Ca2+?和SO42-,可将粗盐溶于水,然后进行下列操作:
①过滤;
②加适量的盐酸;
③加过量的Na2CO3溶液;
④加过量BaCl2溶液.
正确的操作顺序是( )
A.①③④②
B.③①④②
C.①②③④
D.④③①②
参考答案:D
本题解析:
本题难度:一般