1、选择题 下列实验能达到预期目的的是?
[? ]
A.可以用热的浓NaOH溶液来区分植物油和矿物油
B.向经唾液充分作用后的苹果汁中滴入碘水检验淀 粉的存在
C.将纤维素和稀H2SO4加热水解后的液体取出少 许,加入新制的Cu(OH)2并加热,有红色沉淀生 成,证明水解生成了葡萄糖
D.蛋白质溶液中加入丙酮可以使蛋白质从溶液中析 出,再加水又能溶解
2、选择题 下图所示的实验操作,不能达到相应目的的是
[? ]
A.干燥Cl2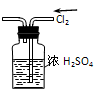
B.检验K2CO3中的K+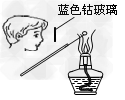
C.证明氨气极易溶于水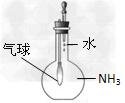
D.实验室制氨气 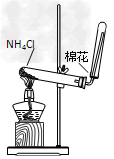
3、实验题 某校化学课外小组用海带为原料制取少量碘水,先用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分解为如下几步: ?
A.把盛有溶液的分液漏斗放在铁架台的铁圈中 ?
B.把50?mL碘水和15?mL?CCl4加入分液漏斗中,并盖好玻璃塞 ?
C.检验分液漏斗活塞和上口的玻璃塞是否漏液 ?
D.倒转漏斗用力振荡,并不时打开活塞放气,最后关闭活塞,把分液漏斗放正 ?
E.旋开活塞,用烧杯接收溶液
F.从分液漏斗上口倒出上层水溶液
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小口对准漏斗口上的小孔
H.静置、分层
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用编号字母填写) _____→_____→_____→A→G→______→E →F。
(2)选用CCl4从碘水中萃取碘的原因是________。
4、简答题 达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料.
(1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下:

所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选.
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为______(只填化学式),b步操作的名称是______.
②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是______,用PH试纸测定滤液ⅡPH值的方法是______.
(2)用提纯的NaCl配制500mL,2.5mol?L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要______(填仪器名称),应称取NaCl______g
(3)下列操作会导致所配NaCl溶液浓度偏高的是______
A、定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线.
B、未将洗涤烧杯内壁的溶液转入容量瓶.?C、定容时,俯视刻度线.
D、转移溶液之前,容量瓶内有少量蒸馏水.?E、称量时,天平指针指向左盘.
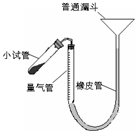
5、简答题 过氧化钙是重要的工业原料,350℃时能迅速分解,生成氧化钙,并放出氧气.工业上将碳酸钙溶于适量的盐酸中,在低温和碱性条件下,与过氧化氢反应制得:CaCO3+2HC1═CaCl2+CO2↑+H2O,CaC12+H2O2+2NH3+8H2O═CaO2?8H2O↓+2NH4Cl.如图是实验室测定产品中过氧化钙含量的装置.试回答下列问题:
(1)上述制备工艺中,分离出主产品的操作方法是______、洗涤、烘干,分离出副产品的操作方法是______、冷却结晶,过滤.
(2)正确读取量气管内液面的初、终读数前都需进行的操作是______.
(3)已知:样品质量m?g,量气管(由滴定管改装)初读数a?mL,
终读数b?mL,该实验条件下气体摩尔体积为c?L?mol-1.样品中过氧化钙的含量表达式=______.
(4)在其他操作正确的情况下,下列操作使测定的结果偏高的是______(填序号).
a.加热使反应完成后,未经冷却就立即读数
b.反应过程中继续往普通漏斗里添加少量的水
c.在反应前后分别采用平视、仰视.