1、选择题 类推是化学研究中常用的一种思维方式,下列有关离子反应方程式推理正确的是
[? ]
已知
推理
A.
向次氯酸钙溶液中通CO2气体:Ca2+?+2ClO-+CO2+H2O=== CaCO3↓+2HClO
向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=== CaSO3↓+2HClO
B.
用惰性电极电解酸铜溶液:2Cu2++2H2O
 2Cu+O2↑+4H+
2Cu+O2↑+4H+
用铜电极电解硫酸铜溶液:2Cu2++2H2O
 2Cu+O2↑+4H+
2Cu+O2↑+4H+
C.
稀硫酸与Ba(OH)2溶液反应,pH=7时,2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O
硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7时,2H++SO42-+Ba2++2OH-=== BaSO4↓+2H2O
D.
Ba(OH)2溶液逐滴滴入硫酸铝钾溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-=== 2BaSO4↓+AlO2-+2H2O
Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-=== 2BaSO4↓+AlO2-+2H2O
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列各项中的两种物质在溶液中的反应可用同一离子方程式表示的是(?)
A.醋酸与氢氧化钠、盐酸与氢氧化钡溶液
B.碳酸钠与足量盐酸、碳酸氢钾与足量稀硫酸
C.硫酸与氢氧化钡溶液、NaHSO4溶液中滴入少量Ba(OH)2
D.碳酸钠与澄清石灰水、碳酸氢钠与澄清石灰水
参考答案:C
本题解析:NaHSO4与少量Ba(OH)2溶液作用,其化学方程式为:NaHSO4+Ba(OH)Ba(OH)2电离出的Ba2+、OH-完全反应,其离子方程式表示为:
2H++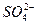 +Ba2++2OH-====BaSO4↓+2H2O
+Ba2++2OH-====BaSO4↓+2H2O
2====BaSO4↓+2H2O+Na2SO4
本题难度:简单
3、填空题 下列离子方程式中正确的是______________
(1)氢氧化亚铁溶于稀硝酸中:Fe(OH)2 + 2H+ = Fe2+ + 2H2O
(2)过量的NaHSO4与Ba(OH)2溶液反应:? Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
(3)向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
(4)过量氯气通入溴化亚铁溶液中3C12 +2Fe2++4Br一=6C1一+2Fe3++2Br2
(5)H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2
(6)NH4HCO3溶液中加足量NaAlO2溶液:NH4++AlO2-+2H2O= NH3·H2O+ Al(OH)3↓
(7)0.1mol/L CuCl2溶液中加入0.1mol/L NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S
(8)等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH-= BaCO3↓+H2O
(9)向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全:
Al3+ +SO42—+Ba2+ +3OH—==BaSO4↓+Al(OH)3↓
(10)NaHCO3溶液水解:HCO3-+ H2O  ?CO32-+ H3O+
?CO32-+ H3O+
(11)硫化钠水溶液呈碱性的原因:S2-+2H2O  ?H2S↑+2OH-
?H2S↑+2OH-
(12)在碳酸氢镁溶液中加入足量Ca(OH)2溶液:
Mg2++HCO3-+Ca2++2OH–="=" MgCO3↓+CaCO3↓+2H2O
(13)用石墨作电极电解AlCl3溶液:2Cl-+2H2O  ?Cl2↑+H2↑+2OH-
?Cl2↑+H2↑+2OH-
(14)向饱和碳酸钠溶液通入过量的二氧化碳气体:CO32-+CO2+H2O=2HCO3-
参考答案:(2)、(3)、(4)、(8)
本题解析:略
本题难度:简单
4、填空题 煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2 Fe2++SO42—
Fe2++SO42— Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
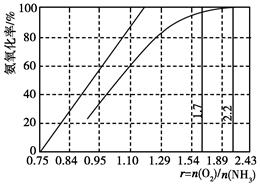
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
参考答案:(1)直接液化技术 间接液化技术
(2)2FeS2+7O2+2H2O 4H++2Fe2++4SO42—
4H++2Fe2++4SO42—
4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
(3)焦炉煤气、粗氨水、煤焦油
(4)1.25
O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%
本题解析:(4)根据反应方程式可知,氨氧化法制备硝酸时的反应是4NH3+5O2=4NO+6H2O,故当氨氧化率达到100%,理论上n(O2)/n(NH3)=5/4=1.25,实际生产中要将氧氨比值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,而且读图可知,比值为2.2时NH3氧化率已近100%。
点拨:本题考查煤的转化及工业制备硝酸,考查考生分析问题、解决问题的能力。难度中等。
本题难度:一般
5、选择题 下列反应的离子方程式正确的是
[? ]
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+==CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl- Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu==Fe2++Cu2+
参考答案:AB
本题解析:
本题难度:一般