1、简答题 括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO(Al2O3)______;
(2)CO2(HCl)______;
(3)FeCl3(FeCl2)______;
(4)NaHCO3溶液(Na2CO3)______.
参考答案:(1)三氧化二铝具有两性可以溶于强碱溶液中,氧化镁不溶,Al2O3+2NaOH=2NaAlO2+H2O,除去三氧化二铝,选用氢氧化钠溶液;
(2)将混合气体通入盛有饱和碳酸氢钠的洗气瓶中发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,除去HCl气体,选用饱和碳酸氢钠溶液;
(3)向混合溶液中通入过量的氯气或者加入过量的氯水发生反应2FeCl2+Cl2=2FeCl3,除去氯化亚铁,选用氯气或者氯水;
(4)向混合溶液中突入足量的二氧化碳发生反应Na2CO3+CO2+H2O═2NaHCO3,除去溶液中的碳酸钠,选用二氧化碳.
故答案为:(1)氢氧化钠溶液;(2)饱和碳酸氢钠溶液;(3)氯气或者氯水;(4)二氧化碳.
本题解析:
本题难度:简单
2、选择题 下列各组物质的分离可用分液漏斗的是
[? ]
A.乙醇和水
B.香油和食盐水
C.黄河水中的泥沙与水
D.从食盐水中获得食盐
参考答案:B
本题解析:
本题难度:简单
3、实验题 有A、B、C、D、E、F六瓶未知溶液。它们是MgSO4、BaCl2、(NH4)2CO3、AgNO3、HBr和NaOH。为了鉴别,各取少许溶液进行两两混合试验,结果如右表。表中“↓”表示有沉淀或生成微溶化合物,“↑”表示有气体生成,“—”表示观察不到明显的现象变化。由此可判断:
A是____B是____C是____
D是____E是____F是____

参考答案:A是(NH4)2CO3? B是NaOH? C是MgSO4? D是BaCl2? E是HBr? F是AgNO3
本题解析:先分析MgSO4与其余五种化合物反应时应观察到的现象:
MgSO4+BaCl2=MgCl2+BaSO4↓?有沉淀生成
MgSO4+(NH4)2CO3=(NH4)2SO4+MgCO3↓?有沉淀生成
MgSO4+2AgNO3=Ag2SO4↓+Mg(NO3)2?有沉淀生成
MgSO4+HBr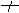 ?无明显变化
?无明显变化
MgSO4+ 2NaOH=Mg(OH)2↓+Na2SO4?有沉淀生成
结果表明MgSO4与其他五种化合物的溶液反应时,应有四种发生沉淀,另一种无明显变化,这与表中C的</PGN0083B.TXT/PGN>情况完全一样,而不同于其他任何一种,故可判定C为MgSO4。再分析BaCl2与其余五种化合物溶液反应时应观察到的现象:
BaCl2+MgSO4=BaSO4↓+MgCl2?有沉淀生成
BaCl2+(NH4)2CO3=BaCO3↓+2NH4Cl?有沉淀生成
BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2?有沉淀生成
BaCl2+2HBr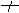 ?无明显变化
?无明显变化
BaCl2+2NaOH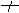 ?无明显变化
?无明显变化
结果是有三种生成沉淀,两种无变化,和D与其他五种溶液反应所得的现象一致,而与其他均不同,故D为BaCl2。
用类似的方法可以判定A为(NH4)2CO3,F为AgNO3,E为HBr,B为NaOH。
本题难度:一般
4、实验题 已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)请填写表中空格,完成由上述混合物得到固体甲的实验设计

参考答案:
本题解析:
本题难度:困难
5、实验题 aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
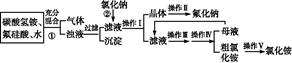
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ?,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤?b.加热蒸发? c.冷却结晶? d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3 NH4F+? H2SiO3↓+ CO2↑+ ?
NH4F+? H2SiO3↓+ CO2↑+ ?
(3)流程①中NH4HCO3必须过量,其原因是? 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
参考答案:(1)除去氟化钠表面的氯化氨杂质 bc
(2)1 6 6 1 6 3 H2O
(3)保证H2SiF6能全部反应,防止在加入NaCl时生成Na2SiF6沉淀
(4)12.6
本题解析:从整个的流程图以及最后得到的产物来看,经①生成的气体是CO2,得到的沉淀是Si元素形成的沉淀。过滤后的滤液中存在F-、N ,加入足量氯化钠后由于氟化钠的溶解度很小,而NaCl、NH4Cl溶解度都较大,所以会生成NaF沉淀;操作Ⅰ是过滤,得到NaF晶体和NH4Cl溶液,操作Ⅱ是洗涤,以除去NaF晶体表面的Cl-、N
,加入足量氯化钠后由于氟化钠的溶解度很小,而NaCl、NH4Cl溶解度都较大,所以会生成NaF沉淀;操作Ⅰ是过滤,得到NaF晶体和NH4Cl溶液,操作Ⅱ是洗涤,以除去NaF晶体表面的Cl-、N 。NH4Cl溶解度较大,需要进行蒸发浓缩、冷却结晶而析出NH4Cl,然后可通过重结晶得到纯净的NH4Cl。在流程①中加入过量NH4HCO3是考虑让H2SiF6完全转化为NH4F,根据原子守恒:m(NaF)=
。NH4Cl溶解度较大,需要进行蒸发浓缩、冷却结晶而析出NH4Cl,然后可通过重结晶得到纯净的NH4Cl。在流程①中加入过量NH4HCO3是考虑让H2SiF6完全转化为NH4F,根据原子守恒:m(NaF)=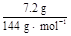 ×6×42 g· mol-1="12.6" g。
×6×42 g· mol-1="12.6" g。
本题难度:一般