1、填空题 V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题:

(1)步骤①所得废渣的成分是?(写化学式),它与NaOH溶液反应的离子反应方程式为?。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)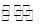 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是?。
②中萃取时必须加入适量碱,其原因是?。
(3)步骤③中X试剂为?,步骤④的目的是?,步骤⑤的离子方程式为?。
(4)该工艺流程中,可以循环利用的物质有?和??。
2、选择题 下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A.乙酸乙酯和水,酒精和水,植物油和水
B.四氯化碳和水,溴苯和水,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇
D.汽油和水,苯和水,己烷和水
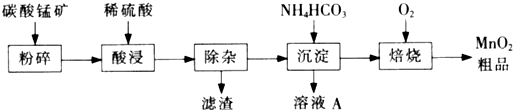
3、填空题 工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Al(OH)2
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Pb(OH)2
| Mn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 8.0
| 8.3
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
| 8.8
| 9.8
|
?
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是?。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为?。 ②加入CaO将溶液的pH调到5.2~6.0,其主要目的是?。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去? 。
(3)从溶液A中回收的主要物质是?,该物质常用作化肥。(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式?。
4、选择题 同温同压下,等质量的O2和O3相比较,下列结论正确的是
A.它们的分子数目之比是 1∶1
B.它们的氧原子数目之比为 2∶3
C.它们的密度之比为 2∶3
D.它们的体积之比是 1∶1
5、选择题 把镁粉中混入的少量铝粉除去,应选用的试剂是
[? ]
A.盐酸
B.氯水
C.烧碱溶液
D.纯碱溶液