|
高考化学知识点归纳《反应速率与平衡的有关计算》高频试题强化练习(2019年最新版)(六)
2019-07-04 00:33:53
【 大 中 小】
|
1、填空题 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题:

(1)图中X曲线代表?(填化学式);
(2)从开始至2min,NH3的平均反应速率是?;
(3)第4分钟时下列叙述正确的是?;
A.该反应已停止
B.单位时间内氮气的消耗速率等于氢气的生成速率
C.3v(H2)=2v(NH3)
D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2
| (4)若拆开1 mol H—H键,1 mol N—H键,1 mol N≡N键分别需要吸收的能量为436 kJ,391 kJ,946 kJ。则1 mol N2与3mol H2反应完全转化为NH3应_________热量(填“吸收”或“放出”)??kJ。
参考答案:(1)H2?(2)0.05?mol/ (L·min)?(3)D(4)放热,?92kJ
本题解析:(1)根据图像可知,反应进行到2min时XYZ的浓度不再发生变化,反应达到平衡状态。此时Z的物质的量增加了0.2mol,X的物质的量减少了0.3mol,Y的物质的量减少了0.1mol,所以图中X曲线代表氢气。
(2)Z表示氨气,则从开始至2min,NH3的平均反应速率是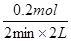 =0.05?mol/ (L·min)。 =0.05?mol/ (L·min)。
(3)反应达到平衡状态时,反应速率不是0,反应并没有停止,A不正确。根据反应速率之比是相应的化学计量数之比可知,选项B不正确;C中不满足反应速率之比是相应的化学计量数之比,C不正确。根据图像可知,选项D正确,答案选D。
(4)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92kJ/mol,所以该反应是放热反应,放出的热量是92kJ。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生知识迁移、读图及表达能力的培养,有利于培养学生的逻辑推理能力和创新思维能力,也有助于调动学生的学习兴趣,激发学生的求知欲。
本题难度:一般
2、填空题 一定条件下,在l L密闭容器中C12(g)、S(g)发生反应(产物只有一种),三种物质的物质的量随时间变化的曲线如图所示,请回答下列问题

(1)生成物的化学式为_______________。
(2)反应进行2min时达到平衡,此时Cl2的平均反应速率v(Cl2)=_________________。
(3)反应达到平衡时,S(g)的转化率为________________。
参考答案:(1)S2Cl2
(2)0.2mol·L-1·min-1
(3)44.4%
本题解析:
本题难度:一般
3、填空题 (14分)
工业合成氨反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。 2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为?。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)="1.2mol," n(H2)="1.2mol," n (NH3)=0.8mol,则反应速率V(N2)=?mol·L-1·min-1,H2的转化率=?,平衡常数=?。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡?(填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为?mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N2?3mol,H2 =?mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=?mol,y=?mol(用含a的代数式表示)
参考答案:(14分)
(1) N2(g) +3H2(g)  2NH3(g),△H=-92.4KJ·mol-1 2NH3(g),△H=-92.4KJ·mol-1
(2) 0.04? 50%? 1.23?向右
(3)? 1-a/2? 9? 2? 3-3a/2
本题解析:略
本题难度:一般
4、计算题 在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0mol,D为6.5mol,F为2.0mol,设E为x mol。当x在一定范围内变化时,均可通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器正中位置。请填写以下空白:

(1)若x=4.5,则右侧反应在起始时向________________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于________________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应平衡时,A的物质的量是否相等?________________(填“相等”、“不相等”或“不能确定”)。其理由是________________。
参考答案:(1)正反应;7.0。
(2)不相等;因为这两种情况是在两种不同温度下达到化学平衡,平衡状态不同,所以物质的量也不同。
本题解析:题中给出一个容积固定的反应器,虽然中间有一个移动隔板,但题中要求隔板处于反应器的正中位置,也就是要求反应容器左右两侧反应的物质的量始终相等。要满足这一条件,①可通过投入E的物质的量即x值的大小来控制;②可通过温度的调节来实现。
(1)反应器左侧的反应为一个反应前后总体积不变化的反应,总物质的量始终为nA+nB+nC=4mol+4mol+4mol=12mol,这就要求反应器右侧也必须始终保持总的物质的量也为12mol。当x=4.5时,右侧反应在起始时总的物质的量为6.5mol+4.5mol+2mol=13mol,大于12mol,此时反应向总体积缩小的方向移动,即向正反应方向进行。由于右侧的正反应是一个体积缩小的反应,E物质参与反应的越多,体积缩小的越多。用极限法,假设投入的E物质全部反应,即E的最大投入量,也就是x的最大取值,则
D(g) + 2E(g)  2F(g) 2F(g)
n始(mol) 6.5 x 2.0
n平(mol) 6.5-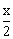 0 2.0+x 0 2.0+x
因左侧反应混合物总的物质的量为12mol,所以达平衡时,右侧反应需满足:
6.5-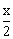 +0+2.0+x=12,x=7 +0+2.0+x=12,x=7
(2)若x分别为4.5和来源:91考试网 91ExAm.org5.0这两种情况时,要满足题中移动隔板恰好处于反应器正中位置的要求,即反应器右侧在z值不同时还始终保持总物质的量为12mol,只有通过条件①即调节温度来实现。也就是说当x的取值在4.5和5.0这两种情况下,当隔板恰处中间位置时的温度是不相同的。再来分析反应器的左侧。由右侧的条件决定x的数值不同,温度不同,在不同的温度下平衡状态不同,各物质的量也就不同。故A的物质的量在这两种情况下也不相等。
本题难度:一般
5、选择题 在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的? CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的?
A.5.75倍
B.11.5倍
C.30.67倍
D.46倍
参考答案:B
本题解析:平衡混合气体与氢气的密度比就等于分子量比。此题的关

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的

为相同条件下H2密度为11.5倍。
本题难度:一般
|