1、填空题 有一包白色粉末状混合物,可能含有Na2CO3、CaCO3、CuCl2、NaCl、Na2SO4、Mg(NO3)2中的一种或几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液;
②取少量上述溶液两份,其中一份加入足量的BaCl2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解;在另一份中加入NaOH溶液,也产生白色沉淀.
(1)根据上述实验现象回答:(填物质的化学式)
原混合物中肯定没有:______
原混合物中肯定有:______
原混合物中不能确定是否含有:______
(2)写出②中产生白色沉淀的所有离子方程式:______
(3)若要确定(1)中不能确定是否含有的物质,可以设计的实验方案是:______.
参考答案:有一包白色固体,可能含有Na2CO3、CaCO3、CuCl2、NaCl、Na2SO4、Mg(NO3)2中的一种或几种,
步骤一:白色固体充分溶解于水,得到无色透明溶液,“无色”说明不含有色的离子或者物质,所以一定不含CuCl2,而“透明”说明该物质一定都可溶且也不能彼此之间反应生成不溶性物质,所以一定不含CaCO3,也不会是Na2CO3和Mg(NO3)2的混合物;
步骤二将溶液中加入足量的BaCl2溶液,产生白色沉淀,而白色沉淀再加入稀盐酸,沉淀不溶解,所以该沉淀一定不是碳酸钡,即原物质中一定不含Na2CO3,所以该沉淀应该是BaSO4,即原物质中一定含Na2SO4,在另一份中加入NaOH溶液,也产生白色沉淀,所以该沉淀应该是与氢氧根离子有关,结合上面的“无色”的特征,则产生的沉淀为氢氧化镁,所以原物质含有Mg(NO3)2,原混合物中不能确定是否含有NaCl,
(1)根据上述分析可知:原混合物中肯定没有:Na2CO3、CaCO3、CuCl2、原混合物中肯定有:Na2SO4、Mg(NO3)2、原混合物中不能确定是否含有:NaCl,
故答案为:Na2CO3、CaCO3、CuCl2;Na2SO4、Mg(NO3)2;NaCl;
(2)②中将溶液中加入足量的BaCl2溶液,产生白色沉淀,而白色沉淀再加入稀盐酸,沉淀不溶解,所以该沉淀应该是BaSO4,发生离子反应:Ba2++SO42-=BaSO4↓;在另一份中加入NaOH溶液,也产生白色沉淀,该沉淀应该是与氢氧根离子有关,产生的沉淀为氢氧化镁,发生的反应为:Mg2++2OH-=Mg(OH)2↓;
故答案为:Ba2++SO42-=BaSO4↓;Mg2++2OH-=Mg(OH)2↓;
(3)原混合物中不能确定是否含有:NaCl,确定是否含有的物质,可以设计的实验方案是:取少量①的溶液于试管中,先加入足量的硝酸钡溶液,振荡静置,取上层清液,再加入足量的硝酸银溶液,若产生白色沉淀,则该沉淀为氯化银,则含有NaCl,若无明显现象,则不含有NaCl,
故答案为:取少量①的溶液于试管中,先加入足量的硝酸钡溶液,振荡静置,取上层清液,再加入足量的硝酸银溶液,若产生白色沉淀,则含有该物质,若无明显现象,则不含有该物质;
本题解析:
本题难度:简单
2、实验题 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表
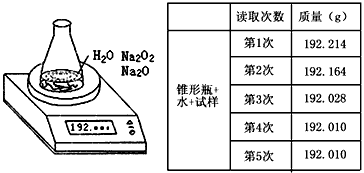
(1)写出Na2O2和H2O反应的化学方程式___________________
(2)计算过氧化钠质量分数时,必需的数据是___________________不必作第6次读数的原因是___________________
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下

①操作Ⅱ的名称是_____________
②需直接测定的物理量是____________?
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要__________(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果________(填偏大、偏小或不变)。
参考答案:(1)2Na2O2+2H2O=4NaOH+O2↑
(2)试样的质量,锥形瓶加水的质量,第四次或第五次的读数;第五次与第四次的读数相同
(3)①蒸发;②生成NaCl的质量;③玻棒、烧杯;④偏大
本题解析:
本题难度:一般
3、简答题 中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显______色,溶液呈______性(填“酸”、“碱”或“中”).
(2)若用pH计测定,则pH______7.0(填“>”、“<”或“=”),溶液呈______性(填“酸”、“碱”或“中”).
参考答案:(1)100℃沸水仍然是中性的,pH试纸测定溶液的酸碱性时,中性溶液不变色,所以是淡黄色的,故答案为:淡黄;中;
?(2)温度升高会促进水的电离,所以水的pH会减小,水在任何温度下均为中性的,故答案为:<;中.
本题解析:
本题难度:一般
4、选择题 下列能达到实验目的的是

[? ]
A.①吸收氨气制氨水
B.②制取少量蒸馏水
C.③转移溶液
D.④除去杂质气体CO2
参考答案:B
本题解析:
本题难度:一般
5、实验题 北京市场销售的某种食用精制盐包装袋上有如下说明
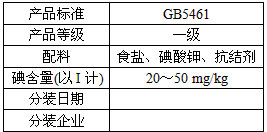
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是___________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-==2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________mg/kg。
参考答案:(1)1、5、3、3、3、3
(2)①I2+SO32-+H2O==2I-+SO42-+2H+;②在步骤b后,增加操作:将分液漏斗充分振荡后静置
(3)①溶液由蓝色恰好变为无色;②1.0×10-5;③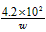
本题解析:
本题难度:一般