1、简答题 环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg/L)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL?5.00×10-3mol/L的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
③将②中溶液取出1/5,加入1.00mL?1.00×10-3mol/L碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化.
(1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式.
(2)计算样品中CO的浓度.
参考答案:(1)CO与I2O5反应生成CO2和I2,碳元素化合价由+2价升高为+4价,共升高2价,碘元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为10,故CO系数为5,I2O5系数为1.由原子守恒可知CO2系数为5,I2系数为1,反应方程式为5CO+I2O5=5CO2+I2.
答:骤①中CO通过盛I2O5加热管的有关反应化学方程式5CO+I2O5=5CO2+I2.
(2)n(I2)=1.00×10-3L×1.00×10-3mol?L-1=1.00×10-6mol
设:1.00×10-6mol?I2消耗Na2S2O3物质的量为x,则:
关系式:2Na2S2O3~I2.
? 2?mol?1mol
? x? 1.00×10-6mol
解得:x=2.00×10-6mol
CO还原出的I2消耗Na2S2O3的物质的量:n(Na2S2O3)=30.0×10-3L×5×10-3mol?L-1-2.00×10-6mol×5=1.40×10-4mol.设:CO的物质的量为y,则:
关系式:2Na2S2O3~I2~5CO
? 2mol? ? 5mol
? 1.40×10-4mol? ? y
解得:y=3.5×10-4mol
CO的浓度为3.5×10-4mol×28g/mol×103mg/g2.00L=4.9mg/L.
答:CO的浓度为4.9mg/L.
本题解析:
本题难度:一般
2、选择题 化学小组测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
[? ]
A.溶液A选用NaOH溶液
B.若溶液B选用浓硝酸,则测得镁的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
参考答案:C
本题解析:
本题难度:一般
3、实验题 碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下
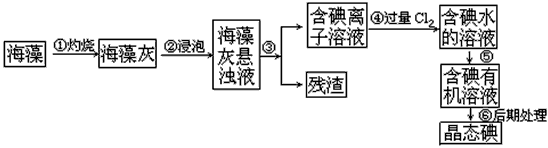
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③_____________,步骤⑤____________。
(2)写出步骤④对应反应的离子方程式:______________________________。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
A. 酒精 B. 醋酸 C. 四氯化碳 D. 苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是
________________________。
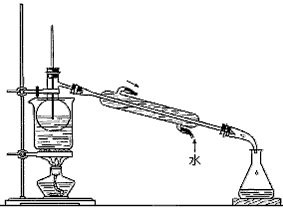
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处:________________________
参考答案:(1)过滤;萃取
(2)Cl2+2I-==I2+2Cl-
(3)CD
(4)分液漏斗、普通漏斗
(5)温度计水银球的位置不对
本题解析:
本题难度:一般
4、选择题 如图所示的实验方法、装置或操作完全正确的是( )
A.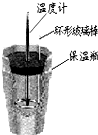
用浓硫酸和氢氧化钠反应测定中和热
B.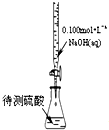
用标准液滴定待测液
C.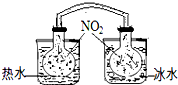
研究温度对平衡的影响
D.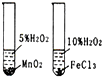
研究不同催化剂对反应速率的影响
参考答案:C
本题解析:
本题难度:简单
5、简答题 现有如下仪器,仪器中已注入溶液,回答下列问题.
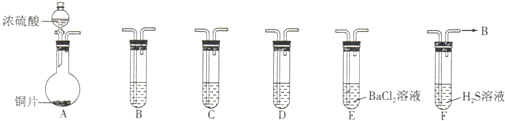
(1)加热装置A,写出铜与浓硫酸反应的化学方程式:______,烧瓶中的实验现象为______.
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为______、______、______.能说明碳的非金属性比硅强的实验现象是______.
(3)验证SO2的氧化性、还原性.若选择A、E、F仪器,并按A、E、F顺序连接.
①则证明SO2有氧化性的实验现象是______,反应方程式为:______.
②若证明SO2具有还原性,在E中采取的实验操作为______,其实验现象为______,反应原理为______.
参考答案:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,由于有气体二氧化硫生成,故在铜表面有气泡冒出,由于浓硫酸具有氧化性,可能有氧化铜生成,铜片变黑色,浓硫酸具有吸水性,生成的无水硫酸铜呈白色,故答案为:Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成;
(2)装置A的作用是除去二氧化硫,装置B的作用是产生二氧化碳,可用碳酸钠或碳酸氢钠,装置C的作用是除去二氧化硫,可以利用强氧化性物质如:酸性高锰酸钾溶液,可防止干扰二氧化碳与硅酸钠溶液的反应,装置D的作用是证明碳酸酸性比硅酸强,选择可溶性硅酸盐,如硅酸钠溶液;利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强原理,故看到的现象为C中KMnO4溶液不褪色,D中出现白色沉淀;
故答案为:Na2CO3溶液或 NaHCO3溶液;KMnO4 溶液;Na2SiO3溶液;C中KMnO4溶液不褪色,D中出现白色沉淀;
(3)①H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,二氧化硫的化合价降低作为氧化剂,具有氧化性,所以看到淡黄色浑浊出现,
反应离子方程式为:2H2S+SO2=3S↓+2H2O,
故答案为:H2S溶液中有浅黄色混浊出现; 2H2S+SO2═3S↓+2H2O;
②要证明二氧化硫具有还原性,可把二氧化硫氧化成硫酸,通过检验硫酸根离子来证明,故可把二氧化硫通入氯化钡溶液中不反应,滴加氯水或高锰酸钾或过氧化氢等氧化剂把二氧化硫氧化成硫酸,硫酸与氯化钡反应生成硫酸钡,涉及方程式为Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,
故答案为:通入氯气(或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂);白色沉定生成;Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
本题解析:
本题难度:一般