|
|
|
高考化学试题《原电池原理》典型例题(三)
2019-07-04 00:47:03
【 大 中 小】
|
1、填空题 将铜、锌通过导线连接,置于硫酸中,请回答下列问题:
(1)以下叙述正确的是 _______ 。(多项选择)
A.电流有锌片流向铜片
B.铜片是正极,锌片是负极
C.烧杯中溶液的H+浓度减小
D.纯锌片换成含有杂质的锌后铜片上产生气泡的速率变慢
| (2)若反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为____________L.
(3)如果把稀硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: ____________。
2、计算题 (6分)在盛有500mL 0.4mol/LH2SO4混合溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:
(1)写出电极反应式:负极_______________;正极_____________________。?
(2)电极上共析出氢气的质量。
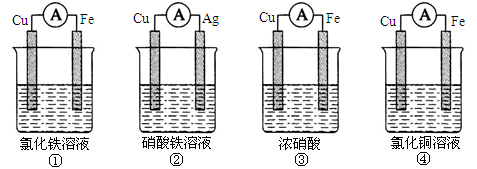
3、填空题 (10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
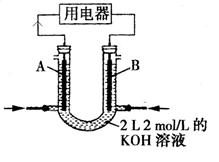
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
4、选择题 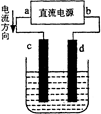 关于如图所示装置的叙述,正确的是 关于如图所示装置的叙述,正确的是
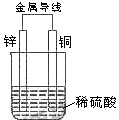
A.Zn为负极,Cu为正极
B.正极反应为Zn-2e→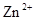
C.负极反应为Cu-2e→
D.该装置能将电能转化为化学能
5、选择题 下列电池工作时能量转化形式与其它三个不同的是

|