1、选择题 如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是
A.铜电极上的反应为Cu-2e-==Cu2+
B.锌电极上的反应为2H++2e-==H2↑
C.锌片是负极,铜片是正极
D.电子由铜片经导线流向锌片
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子,铜是正极,溶液中的氢离子得到电子,所以答案选C。
本题难度:一般
2、填空题 (5分)利用下述反应 2FeCl3+Cu=2FeCl2+CuCl2设计一个原电池装置;试回答:(1)(3分)该原电池的正极材料是 ,负极材料是 , 电解质溶液是 。
(2)该原电池的负极反应式为 ,正极反应式为
。
参考答案:(1)石墨 铜 FeCl3溶液
(2)负极:Cu-2e-=Cu2+ 正极:2Fe3++2e-=2Fe2+
本题解析:略
本题难度:简单
3、选择题 下列关于如图装置的说法正确的是( )
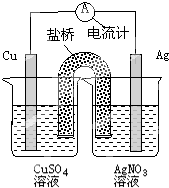
A.银电极是负极
B.铜电极上发生的反应为Cu-2e-=Cu2+
C.外电路中的电子是从银电极流向铜电极
D.该装置能将电能转化为化学能
参考答案:A.该原电池中,铜是负极,银是正极,故A错误;
B.铜电极上铜失去电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故B正确;
C.外电路中的电子从铜电极沿导线流向银电极,故C错误;
D.该装置没有外接电源,是将化学能转变为电能的装置而不是将电能转变为化学能的装置,故D错误.
故选B.
本题解析:
本题难度:简单
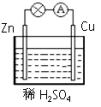
4、选择题 在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极有O2逸出
B.铜片上有H2逸出
C.正极附近的SO42-离子浓度逐渐增大
D.电子通过导线由铜片流向锌片
参考答案:A、正极上氢离子得电子生成氢气,有H2逸出故A错误;
B、铜片作正极,正极上氢离子得电子生成氢气,故B正确;
C、原电池放电时,溶液中阴离子向负极移动,所以阴极附近的SO42-浓度逐渐增大,故C错误;
D、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故D错误.
故选B.
本题解析:
本题难度:简单
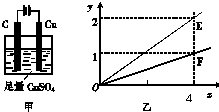
5、选择题 用如图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量.下列叙述不正确的是( )
A.E表示反应生成Cu的物质的量
B.E表示反应消耗H2O的物质的量
C.F表示反应生成H2SO4的物质的量
D.F表示反应生成O2的物质的量