| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《盐类水解的原理》练习题(十)
参考答案:C 本题解析:pH之和等于14的酸碱等体积混合,因为氨水是弱碱,继续电离,所以显碱性。 本题难度:困难 2、填空题 磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
①反应在50~150s 内的平均速率v(PCl3)= 。 ②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字) (3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。 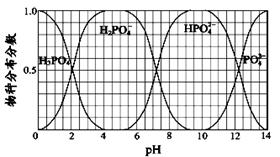 ①为获得较纯的Na2HPO4,pH应控制在 ;pH=6时,溶液中主要含磷物种浓度大小关系为: 。 ②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析) 。 参考答案:(1)①PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol(2分,方程式1分,△H的表示1分,化学式、状态错误0分;+、焓变数值、单位错漏合扣1分;计量数用分数表示与焓变相匹配也给分) 本题解析:(1)①题干中特别注明图中物质转化的焓变是生成1mol产物的数据,因此PCl5分解成PCl3和Cl2是吸热反应,其热化学方程式为:PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol; 本题难度:困难 3、选择题 下列叙述中,不正确的是 ( )。 |
参考答案: B
本题解析: 本题综合考查盐类水解、弱电解质的电离等,意在考查考生的综合思维能力。c(NH4+)相等的(NH4)2SO4和NH4Cl溶液中浓度较大的是NH4Cl,故A项正确;B项反应后的溶液中溶质为醋酸钠,因醋酸根水解使溶液呈碱性,故溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);C项,若HA为强酸,则c1=10c2,若HA为弱酸,c1>10c2;由物料守恒与电荷守恒可知D项正确。
本题难度:一般
4、选择题 常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中(?)。
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+)
D.无法确定
参考答案:C
本题解析:本题绝不能理解为恰好反应,因完全反应生成甲酸钠为强碱弱酸盐,溶液呈碱性,而现在Ph=7,故酸略为过量。根据溶液中电荷守恒:c(Na+)+ c(H+)= c(HCOO-)+c(OH-)
因pH=7,故c(H+)= c(OH-),所以有c(Na+)= c(HCOO-),答案为C。
本题难度:简单
5、选择题 下列有关说法正确的是
A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
参考答案:A
本题解析:A.NH3(g)+HCl(g)= NH4Cl(s)是一个熵减的反应,根据判据如果在室温下可自发进行,则该反应的△H<0,正确;B.金属活泼性:锌>铁>锡,当镀锡铁和镀锌铁镀层破损时,前者中的铁更易被腐蚀,错误;C.CH3COOH溶液加水稀释后,电离平衡正向移动,OH-的浓度增大,但其它微粒的浓度减少,错误;D.Na2CO3溶液中加入少量Ca(OH)2固体,反应生成CaCO3,CO32-水解程度增大,但溶液的pH减小,错误。
考点:考查化学反应自发进行的判据,金属的腐蚀与防护,电离平衡,盐的水解。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《苯和芳香烃.. | |