| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《盐类水解的原理》练习题(八)
参考答案:A 本题解析:A、碳酸钠为强碱弱酸盐,水溶液显碱性,油污在碱性条件下可以发生水解,从而被除去,正确;B、浓硝酸可使金属铝钝化,而浓硝酸可以与金属铜发生氧化还原反应,错误;C、金属铝的熔点是660℃,相对较低,不能用于制作耐高温的材料,可制耐高温材料的是Al2O3,错误;D、浓硫酸具有吸水性,可用于干燥中性或者酸性气体,氨气为碱性气体,不能用浓硫酸干燥,错误;故本题选择A。 本题难度:一般 3、选择题 NH4Cl溶液中,下列叙述正确的是( ) |
参考答案:BD
本题解析:氯化铵由于NH4+水解,溶液显酸性,A不正确,B正确。根据电荷守恒c(NH4+) + c(H+) = c(Cl—) + c(OH— )可知C是错误的。根据氮原子守恒可知,D正确。答案选BD。
本题难度:困难
4、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
参考答案:(1)MgCl2(熔融)电解Mg+Cl2↑ (2)2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol
(3)50;抑制SnCl2水解 (4)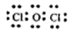 ;2HClO光照2H++2Cl-+O2↑
;2HClO光照2H++2Cl-+O2↑
(5)Al-3e-+4OH-=AlO2-+2H2O
本题解析:A、B、C、D为原子序数依次增大的四种第三周期元素,工业上常用电解熔融AD2制取A的单质,说明A应该是活泼的金属镁。B的最外层电子数比最内层电子数多1,因此B的原子序数是13,是铝元素。C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂,则C是硅元素。D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强,该弱酸性物质应该是次氯酸,即D是氯元素。甲的相对分子质量是3×29=87,所以甲是Cl2O。
(1)工业上电解熔融的氯化镁冶炼单质镁,反应的化学方程式为MgCl2(熔融)电解Mg+Cl2↑。
(2)13.5g的铝的物质的量是13.5g÷27g/mol=0.5mol,完全与氯气反应放出419 kJ的热量,因此2mol完全反应放出的热量是419 kJ×4=1676kJ,则反应的热化学方程式为2Al(s)+3Cl2(g)=2AlCl3(s) △H=-1676kJ/mol。
(3)Sn与元素硅同主族,周期数比元素硅的大2.则Sn的原子序数为14+18+18=50;+2价的锡在溶液中易水解,因此配制SnCl2溶液时需用盐酸溶解其晶体的目的是抑制SnCl2水解。
(4)甲中各原子都满足8电子稳定结构,这说明氧元素形成2对共用电子对,因此其电子式为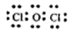 ;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
;次氯酸不稳定,见光易分解生成氯化氢和氧气,所以溶液的酸性增强,反应的用离子方程式为2HClO光照2H++2Cl-+O2↑。
(5)镁的金属性强于铝,但与氢氧化钠溶液反应的是铝,而不是镁,所以将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中镁是正极,铝是负极,负极反应的电极方程式为Al-3e-+4OH-=AlO2-+2H2O。
考点:考查元素推断、金属冶炼、热化学方程式、元素周期表的结构、电子式、次氯酸以及原电池原理等
本题难度:困难
5、选择题 下列有水参加的化学反应中,不属于水解反应的是( ? )
A.NH3+H2O?NH4++OH-
B.HCO3-+H2O?H2CO3+OH-
C.Al3++3H2O?Al(OH)3+3H+
D.NH4++2H2O?NH3?H2O+H3O+
参考答案:A
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《苯和芳香烃.. | |